
 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2CO1��H = Q1kJ��mol-1��Ӧ�ٶ�Ϊv1��
2CO1��H = Q1kJ��mol-1��Ӧ�ٶ�Ϊv1�� 2NH3 ��H = -Q2kJ��mol-1��Ӧ�ٶ�Ϊv2������������Ӧ��
2NH3 ��H = -Q2kJ��mol-1��Ӧ�ٶ�Ϊv2������������Ӧ��| A��ͬʱ���� | B��ͬʱ��С | C������С | D����С������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2CO(g)����Ӧ��������Ĵ�ʩ��
2CO(g)����Ӧ��������Ĵ�ʩ��| A����СCO��Ũ�� | B������̼������ | C��ͨ��He�� | D������CO2Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
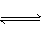 HCl��HClO����������һ���ݻ�Ϊ50mL����Ͳ(��ͼ��ʾ�����������ɻ�������Ͳ���п̶�)������40mLCl2��10mL H2O��
HCl��HClO����������һ���ݻ�Ϊ50mL����Ͳ(��ͼ��ʾ�����������ɻ�������Ͳ���п̶�)������40mLCl2��10mL H2O��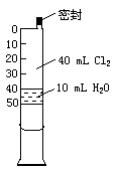
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 B �ۢ� C �٢� D �ڢ�
B �ۢ� C �٢� D �ڢ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ�� ��� | I���ij�ʼŨ�� (mol��L-1) | OCl���ij�ʼŨ�� (mol��L-1) | OH���ij�ʼŨ�� (mol��L-1) | ��ʼ����v (mol��L-1�� s-1) |
| 1 | 2 �� 10�C3 | 1.5 �� 10�C3 | 1.00 | 1.8 �� 10�C4 |
| 2 | a | 1.5 �� 10�C3 | 1.00 | 3.6 �� 10�C4 |
| 3 | 2 �� 10�C3 | 3 �� 10�C3 | 2.00 | 1.8 �� 10�C4 |
| 4 | 4 �� 10�C3 | 3 �� 10�C3 | 1.00 | 7.2  �� 10�C4 �� 10�C4 |
 ֪���г�ʼ��Ӧ�������й�����Ũ�ȹ�ϵ���Ա�ʾΪv=" k" [I��]1 [OCl��]b [OH��]c���¶�һ��ʱ��kΪ��������
֪���г�ʼ��Ӧ�������й�����Ũ�ȹ�ϵ���Ա�ʾΪv=" k" [I��]1 [OCl��]b [OH��]c���¶�һ��ʱ��kΪ�������� = ��
= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g) + H2(g) ��H>0��Ϊ�����C(S)��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ� ��
CO(g) + H2(g) ��H>0��Ϊ�����C(S)��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ� ��| A�����߷�Ӧ�¶� | B�����ͷ�Ӧ�¶� |
| C������ѹǿ | D���ټ���һЩC(S) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������Ը��������Һ��Ũ�� | B�����������Һ��Ũ�� |
| C������ѹǿ | D�������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ֻ�Т� | B��ֻ�Тڢ� | C��ֻ�Т٢ڢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com