
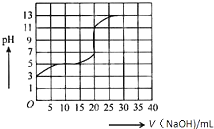
 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 A、弱酸不能完全电离;
B、弱酸的浓度未知;
C、用强碱滴定弱酸,滴定重点显弱碱性;
D、当强碱和弱酸恰好完全反应时为滴定终点,此时得到的是NaA溶液.
解答 解:A、由于弱酸在滴定前的pH=3,即氢离子浓度为0.001mol/L,而弱酸不能完全电离,故滴定前弱酸的浓度为0.001mol/L,故A正确;
B、由于弱酸的电离平衡常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)_{\;}}$≈$\frac{c({H}^{+})•c({A}^{-})}{c(HA)_{初始}}$,但弱酸的初始浓度未知,故Ka无法求算,故B错误;
C、用强碱滴定弱酸,滴定重点显弱碱性,故用酚酞做指示剂最合适,故C正确;
D、当强碱和弱酸恰好完全反应时为滴定终点,此时得到的是NaA溶液,溶液显碱性,故有:c(OH-)>c(H+),而根据溶液的电中性可知:c(Na+)+c(H+)=c(A-)+c(OH-),故有:c(Na+)>c(A-),故可知:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确.
故选B.
点评 本题考查了酸碱中和滴定过程中的离子浓度大小比较和指示剂的选择问题等,是高考的常考题型,对解题能力要求较高,难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
 ;反应类型加聚反应.
;反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰与水作用制熟石灰 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
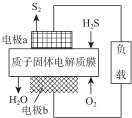 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极 b 上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 该装置是一种将热能转化为电能的装置 | |
| D. | H+经质子膜进入a极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧 | B. | 二氧化氮 | C. | 二氧化硫 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com