
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
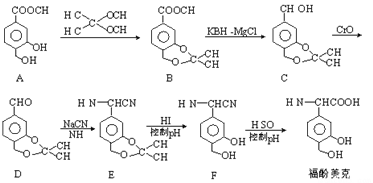
(1)B中的含氧官能团有______________和______________(填名称)。
(2)C→D的转化属于_______________反应(填反应类型)。
(3)已知E→F的转化属于取代反应,则反应中另一产物的结构简式为_______________。
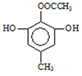
(4)A(C9H10O4)的一种同分异构体X满足下列条件:
Ⅰ.X分子有中4种不同化学环境的氢。
Ⅱ.X能与FeCl3溶液发生显色反应。
Ⅲ.1molX最多能与4molNaOH发生反应。
写出该同分异构体的结构简式:_______________。
(5)已知: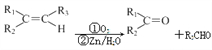 ,根据已有知识并结合相关信息,写出以
,根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备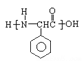 的合成路线流程图(无机试剂任用)______。
的合成路线流程图(无机试剂任用)______。
【答案】 醚键 酯基 氧化 ![]()
 (或
(或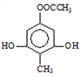 )(写一个即给分,但表达不准确不给分)
)(写一个即给分,但表达不准确不给分) 
【解析】(1)根据B的结构简式可知B中含氧官能团的名称是酯基和醚键;(2)C中的醇羟基变为D中的醛基,发生氧化反应,所以C到D的反应类型是氧化反应;(3)根据F的结构简式可知,E中的醚键断裂,上去2个H原子,则另一种产物是HI中的I原子与-C-相连,则其结构简式为![]() ;(4)根据题意可知X的分子中含有酚羟基,1mol X最多能与4 mol NaOH发生反应,若X分子中含有4个酚羟基和1个碳碳双键,则其分子中的H原子的种数不只4种,所以X的分子中不可能含有4个酚羟基;若X分子中有3个酚羟基和1个醛基,则不能满足1mol X最多能与4 mol NaOH发生反应的条件;若X分子中含有2个酚羟基,则其分子中还应含有酯基且该酯基是酚羟基与羧酸构成的酯才能满足题意,结合H原子的种数,则X的结构简式是
;(4)根据题意可知X的分子中含有酚羟基,1mol X最多能与4 mol NaOH发生反应,若X分子中含有4个酚羟基和1个碳碳双键,则其分子中的H原子的种数不只4种,所以X的分子中不可能含有4个酚羟基;若X分子中有3个酚羟基和1个醛基,则不能满足1mol X最多能与4 mol NaOH发生反应的条件;若X分子中含有2个酚羟基,则其分子中还应含有酯基且该酯基是酚羟基与羧酸构成的酯才能满足题意,结合H原子的种数,则X的结构简式是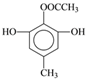 或
或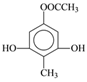 ;(5)根据题意可知,
;(5)根据题意可知,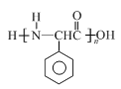 的单体是
的单体是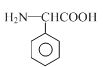 ,由
,由 先发生消去反应,使其分子中产生碳碳双键,然后根据已知信息,在
先发生消去反应,使其分子中产生碳碳双键,然后根据已知信息,在![]() 的条件下得到苯甲醛,结合制取福酚美克的流程,仿照D到福酚美克的反应流程即可得到
的条件下得到苯甲醛,结合制取福酚美克的流程,仿照D到福酚美克的反应流程即可得到 ,该单体再发生缩聚反应即可得到所求产物,所以该物质的制备流程是
,该单体再发生缩聚反应即可得到所求产物,所以该物质的制备流程是
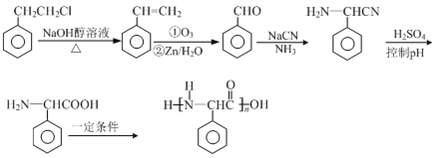 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】l3C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( )
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A.油脂水解的产物中含甘油
B.塑料、合成树脂和合成橡胶被称为“三大合成材料”
C.蛋白质可水解生成多肽和氨基酸
D.医疗上用 75%的酒精消毒是因为其能使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
A. F2、K、HCl B. Cl2、Al、H2
C. NO2、Na、Br2 D. O2、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=__________;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为________;反应达到平衡后,升高温度,此时平衡常数将____(填“变大”、“不变”或“变小”)。
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式_______________________________。在电解池中生成N2O5的电极反应式为__________________________________。

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com