
室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
A. 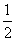 lg(
lg( 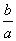 ) B.
) B. 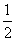 lg(
lg( 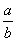 )
)
C.14+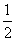 lg(
lg( 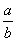 ) D.14+
) D.14+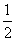 lg(
lg( 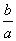 )
)
科目:高中化学 来源: 题型:
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
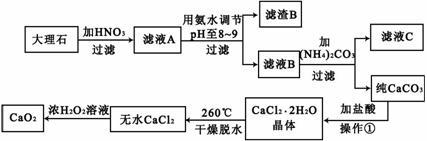
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,将x mL pH=a 的稀KOH溶液与ymL pH=b的稀硝酸充分反应。下列关于反
应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
A.t ℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t ℃时,将0.01 mol·L-1 AgNO3溶液滴入20mL0.01 mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
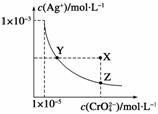
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母),原因是________ 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是________________。
②反应结束后,无需过滤,除去过量铁粉的方法是______________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中,下列各组离子能大量共存的是
A. Al3+、SO42-、NH4+ B. Ag+、NO3-、Cl-
C. Fe3+、OH-、SCN- D. K+ 、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:

(1)原料A的名称是_______________。
(2)滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应涉及的离子方程式是:_____________________________________________________________________________。
(3)步骤③所得沉淀的化学式为:________________。ks5u
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是:
;
②写出由CaCl2通过化合反应制备CaCl的化学方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com