
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是
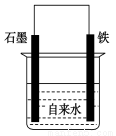 A.正极的电极方程式为:O2+2H2O+4e-===4OH-
A.正极的电极方程式为:O2+2H2O+4e-===4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
下列解释实验事实的化学方程式正确的是
A.5molFe和4molCl2反应:5Cl2+4Fe点燃2FeCl2+2FeCl3
B.2molKMnO4和3molH2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=Mn2++4O2↑+6H2O
C.在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O
D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B.升高温度,使活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞均为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:填空题
现有室温下浓度均为1×10-3mol/L的几种溶液:
①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ________ ⑥(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH ________ 7(填“>”、“<”或“=”)
用离子方程式说明其原因 _______________________
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的为________ (填写序号)
最终产生H2总量的关系为___________(填写序号)
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① _________ ③(填“>”、“<”或“=”)
(5)将等体积的⑤、⑥溶液加热至同温度后,溶液的pH ⑤ _____ ⑥(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
下列叙述正确的是
A.在原电池的正极和电解池的阳极上发生的都是氧化反应
B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2∶1
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4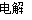 CuSO4+H2↑
CuSO4+H2↑
D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
相同温度、相同浓度的溶液,pH值最小的是
A. NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2 SO4
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:填空题
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)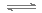 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
T | 298 K | 398 K | 498 K | … |
K | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系,其关系如图所示。下列说法错误的是( )
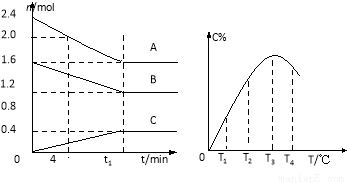
A.0~4分钟时,A的平均反应速率为 0.01mol·L?1·min?1
B.由T1向T2变化时,V正>V逆
C.此反应的正反应为吸热反应
D.其它条件不变,加压,达新平衡时,C的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
某溶液中大量存在以下五种离子:NO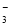 、SO42-、Fe3+、H+、M,其物质的量之比为
、SO42-、Fe3+、H+、M,其物质的量之比为
n(NO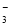 )∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则 M可能为( )
)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则 M可能为( )
A.Cl- B.Mg2+ C.Ba2+ D.Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com