
现有下列短周期元素性质的数据,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | ﹣2 | +2 | +1 | +5;﹣3 | +7;﹣1 | +1 | +5;﹣3 | +3 |
|
| A. | ⑧号元素为Al |
|
| B. | ②、③处于同一周期 |
|
| C. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 |
|
| D. | ④元素的气态氢化物沸点大于⑦元素的氢化物 |
考点:
原子结构与元素周期律的关系.
专题:
元素周期律与元素周期表专题.
分析:
短周期元素,④⑦都有最高价+5、最低价﹣3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、﹣1价,则⑤为Cl;①有最低价﹣2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,据此解答.
解答:
解:短周期元素,④⑦都有最高价+5、最低价﹣3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、﹣1价,则⑤为Cl;①有最低价﹣2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,
A.由上述分析可知,⑧为B,故A错误;
B.②为Mg,③为Li,二者分别处于第三、第二周期,故B错误;
C.上述八种元素中⑤为Cl,非金属性最强,其最高价氧化物对应的水化物酸性最强,故C正确;
D.④为P、⑦为N,氨气分子之间存在氢键,沸点较高,故D错误,
故选C.
点评:
本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的掌握.


科目:高中化学 来源: 题型:
下列实验能获得成功的是( )
|
| A. | 苯、溴水、铁粉混合制成溴苯 |
|
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 |
|
| C. | 用高锰酸钾酸性溶液来区别甲烷和乙烯 |
|
| D. | 可用水来鉴别苯跟四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.pH<7的溶液不一定是酸溶液
B.常温下,pH=5的溶液和pH=3的溶液相比,前者[OH-]不一定是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使[NH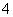 ]增大,则溶液的pH一定增大
]增大,则溶液的pH一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
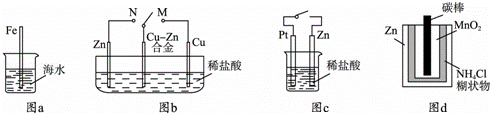
|
| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
|
| B. | 图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小 |
|
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
|
| D. | 图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粉和6mol•L﹣1的过量盐酸反应,当向其中加入少量的下物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是( )
|
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡的标志是 (填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
⑧混合气体的平均相对分子质量不再改变
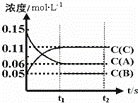
(2)向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示.已知在反应过程中混合气体的平均分子量没有变化.请回答:
①密闭容器的体积是 L.
②若t1=15s时,则t0﹣t1阶段以C物质浓度变化表示的反应速率为v(C)= .
③写出反应的化学方程式: .
④B的起始物质的量是 .
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: .若1g水蒸气转化为液态水放热2.44kJ,则反应2H2(g)+O2(g)═2H2O(l)△H= kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
离子RO3n﹣中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目( )
|
| A. | A+n+48+x | B. | A﹣n﹣24﹣x | C. | A﹣n+24﹣x | D. | A+n+24﹣x |
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3moL气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5KJ热量,请写出乙硼烷燃烧的热化学方程式 ;又已知:H2O(l)→H2O(g);△H=+44kJ/moL,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com