
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH不同
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
下列液体均处于25 ℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.25 ℃时,用pH试纸测定出某醋酸溶液的pH=3.50
D.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:选择题
为了探究外界条件对反应aX(g)+bY(g)  cZ(g)的影响,以X和Y物质的量之比为a∶
cZ(g)的影响,以X和Y物质的量之比为a∶
b开始反应,通过实验得到不同条件下达到平衡时Z的体积分数,实验结果如下图所示。以下判断正确的是( )
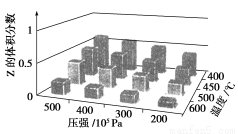
A.ΔH>0,a+b>c B.ΔH>0,a+b<c
C.ΔH<0,a+b>c D.ΔH<0,a+b<c
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练6-1练习卷(解析版) 题型:填空题
当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、
污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:
①C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式 。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练6-1练习卷(解析版) 题型:选择题
下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:选择题
X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形
成的常见化合物或者离子不可能是( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.可形成双核离子或者四核离子
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:选择题
下列过程中,共价键被破坏的是( )
A.碘升华
B.二氧化氮被木炭吸附
C.酒精溶于水
D.HCl气体溶于水
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-1练习卷(解析版) 题型:填空题
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.富含硫黄的矿物在工业上可用于制造硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com