
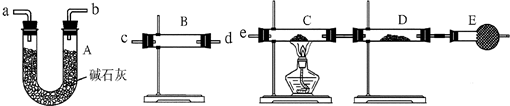
某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):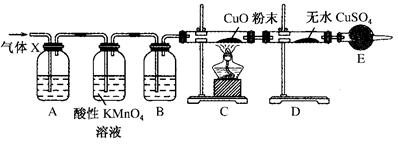
试回答:
(1)上述实验中生成二氧化硫气体的化学反应方程式为
_________________________________________________________。
(2)乙同学认为还可能产生氢气的理由是____________________ _____________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作___________________________________________。
(4)B中加入的试剂是________,其作用是___________________ _____________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中________,D中________。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?
答: ___________________________________________________。
(1)Zn+2H2SO4(浓)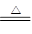 ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
(2)在锌与浓硫酸的反应过程中,H2SO4被消耗,且有水生成,c(H2SO4)逐渐减小,由浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气
(3)检验装置气密性
(4)浓硫酸, 吸收水蒸气
(5)黑色氧化铜粉末变成红色, 无水硫酸铜粉末由白色变成蓝色,不能,混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验
解析试题分析:(1)浓硫酸具有强氧化性,和锌反应的化学方程式是:Zn+2H2SO4(浓)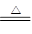 ZnSO4+SO2↑+2H2O。
ZnSO4+SO2↑+2H2O。
(2)由于锌在与浓硫酸的反应过程中,H2SO4被消耗,且有水生成,导致c(H2SO4)逐渐减小。当浓硫酸变成稀硫酸后,锌就与稀硫酸反应生成氢气。
(3)任何实验装置连接好以后,都需要检验装置的气密性。
(4)由于要通过无水硫酸铜是否变蓝来证明气体是否含有氢气,所以在和氧化铜反应之前,首先要干燥气体,因此B中加入的试剂是浓硫酸,原来吸收水蒸气。
(5)如果实验中黑色氧化铜粉末变成红色,无水硫酸铜粉末由白色变成蓝色,即可以说明含有氢气;由于混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验,所以如果撤去装置B,就不能根据D中的现象判断气体X中含有氢气。
考点:考查浓硫酸的性质、气体的检验、除杂以及实验安全等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的――实验原理;3.结合实验材料,初步确定设计对策--实验方案。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 无水硫酸铜 |
固体由白色变成蓝色 固体由白色变成蓝色 |
SO2中含有水蒸气 SO2中含有水蒸气 |
| C | CuO固体 | C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 |
SO2中含有氢气 SO2中含有氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
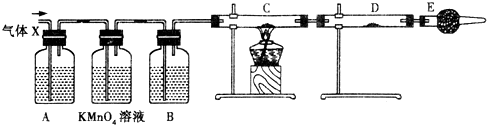
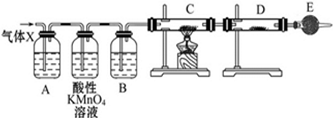 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com