
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA
B.25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2 NA
C.常温常压下,4. 4gCO2和N2O混合物中所含有的原子数为0.3 NA
D.标准状况下,2. 24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA。
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.某有机物燃烧后产物只有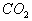 和
和 ,可推出的结论是有机物属于烃
,可推出的结论是有机物属于烃
B.某有机物燃烧后产物只有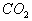 和
和 ,可推出的结论是有机物属于烃的含氧衍生物
,可推出的结论是有机物属于烃的含氧衍生物
C.某有机物燃烧后产物只有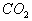 和
和 ,通过测定有机物、
,通过测定有机物、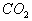 和
和 的质量,可确定有机物是否含有氧
的质量,可确定有机物是否含有氧
D.甲烷在同系物中含碳量最高,因而是清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.糖类化合物都具有相同的官能团 B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇 D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:

(1) a、b、c分别代表什么意义?
a ;
b ;
c 。
(2) 该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(3)已知:H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1 H2(g)
H2O(l) ΔH=-285.8 kJ·mol-1 H2(g) H2(l) ΔH=-0.92 kJ·mol-1 O2(g)
H2(l) ΔH=-0.92 kJ·mol-1 O2(g) O2(l) ΔH=-6.84 kJ·mol-1 H2O(l)
O2(l) ΔH=-6.84 kJ·mol-1 H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。试填空

(1)B的化学式________。
(2)反应⑤中氧化剂与还原剂的物质的量之比为 。
(3)写出反应⑦的离子方程式_____________________。
(4)写出电解X溶液的阳极反应式______________________;若电解一段时间后转移了0.2mol电子,则此时电解产生的气体在标准状况下的体积为 。
(5)写出反应④的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是 ( )
①都是主族元素,原子的最外层电子数都大于3;②单质在反应中都只能作氧化剂;③对应的含氧酸都是强酸;④氢化物常温下都是气态,所以又叫气态氢化物;⑤氧化物与水反应都不会再生成气体
A.全部 B.只有① C.只有①②③ D.只有①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修2化学与技术](15分)
近年,为提高能利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 .
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com