
由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
1)在一个容积为3L的密闭容器内进行如下反应:N2(气)+3H2(气)⇌2NH3(气).反应开始时,n(N2)=1.5mol,n(H2)=4.4mol,2min后达到平衡状态,n(H2)=3.5mol.用NH3的浓度变化来表示该反应的反应速率为 ,2min末N2的浓度 ,平衡时N2的转化率为 .
(2)在密闭容器中,对于反应:N2(g)+3H2(g)⇌2NH3(g),在反应起始时N2和H2 分别为5mol和15mol,当达到平衡时,N2的转化率为20%.若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量为 ,NH3的转化率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可能有( )
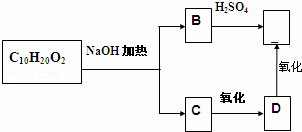
A. 2种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+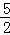 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个热化学方程式:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol.
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是()
A. 1:1 B. 1:2 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是()
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. 由元素的原子序数推测其在元素周期表中的位置
B. 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低
C. 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个
D. 由N-N、H-H、N-H的键能数据估算3H2(g)+N2(g)  2NH3(g)的反应热
2NH3(g)的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com