

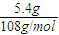 =0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol,
=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol,

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
 如图所示原电池装置,回答下列问题:
如图所示原电池装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)写热化学方程式:
(1)写热化学方程式:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2010年湖南省业水平考试化学卷 题型:选择题
如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是

A、锌做负极发生氧化反应
B、供电时的总反应为:Zn + H+ = Zn2+ + H2
C、该装置可实现化学能转化为电能
D、产生1molH2,消耗锌的质量32.5g
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com