
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
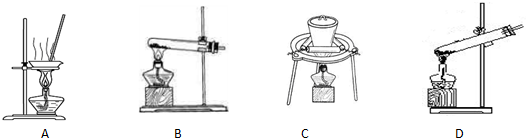
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。




A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
(1)NaCl + NH3 + CO2 + H2O = NaHCO3 ↓+ NH4Cl (3分,没有“↓”扣1分)
(2)BC (2分)
(3)(12分)
| 步骤一:取少量制品于试管中,加入少量蒸馏水,振荡,溶解:往试管中加入 过量的Ba(NO3)2溶液(2分),振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3 。(1分) |
| 步骤二:将步骤一的浊液过滤:取滤液于试管B中,加入少量的NaOH溶液(或澄清石灰水)(2分), 振荡,观察 | 现象:有少量白色沉淀生成 ;(1分) 结论:试样中含有NaHCO3 。 |
| 步骤三: 将步骤二的浊液过滤后,取滤液于试管C中,先加入过量的稀硝酸(2分),再加2-3滴(或少量)AgNO3溶液(2分),振荡,观察 |
现象:有少量白色沉淀生成 ;(1分) 结论:试样中含有NaCl 。(1分) |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入 |
现象:溶液中产生大量白色沉淀; 结论: |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 振荡,观察 |
现象: 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.残渣中主要成分是Ca(OH)2和 。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是 。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2 升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因 。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是 。
③图示的溶液A可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省珠海市高三5月综合测试(二)理综化学试卷(解析版) 题型:实验题
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。

A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
|
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 |
现象:溶液中产生大量白色沉淀;
结论: 。 |
|
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 |
现象: ; 结论:样品中含有NaHCO3 。 |
|
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象: ; 结论: 。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
② 加少许淀粉溶液,用c mol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③ 重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com