
| A. | 电解熔融的氯化钠中铁电极连接电源的负极 | |
| B. | 电解熔融的氯化钠中石墨电极作阳极发生氧化反应 | |
| C. | 可用电解饱和氯化钠溶液来制备金属钠 | |
| D. | 熔融氯化钠的电离是在电流的作用下发生的 |
分析 A.铁可别氧化,电解氯化钠时铁应为阴极;
B.电解时,可用石墨等惰性电极;
C.若对饱和氯化钠溶液进行电解,生成氢氧化钠、氢气和氯气;
D.电离是在水或熔融的作用下才发生的,不需要电的作用.
解答 解:A.电解熔融的氯化钠中有两个电极,分别是铁电极与石墨电极,由于铁非常活泼易失电子,故铁只能与电源的负极相连,而石墨不易失电子作阳极,该极上发生氧化反应,故A正确;
B.电解时,阳极发生氧化反应,可用石墨等惰性电极,故B正确;
C.若对饱和氯化钠溶液进行电解,由于钠离子的氧化性比氢离子的弱,故得不到金属钠,即使得到了,在水溶液中,钠也会剧烈的与水反应,故C错误;
D.电离是在水或熔融的作用下才发生的,不需要电的作用,故D错误.
故选CD.
点评 本题考查了电解原理,根据电解过程中阴阳极上得失电子来分析解答,易错选项是A,注意活泼金属采用电解的方法冶炼,钠、钾等活泼金属采用电解其熔融盐的方法冶炼,而铝采用电解熔融氧化铝的方法冶炼,为易错点.


科目:高中化学 来源: 题型:选择题
 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )| A. | 该物质的分子式为S4N4 | |
| B. | 该物质的分子中既有极性键又有非极性键 | |
| C. | 该物质的分子中N、S原子均采取sp3杂化 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

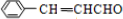 ;
;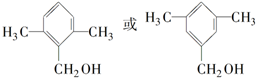 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
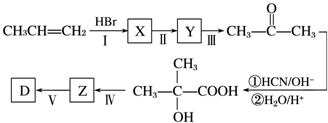
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
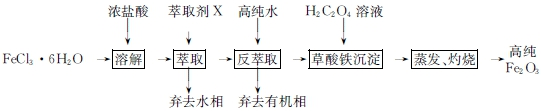
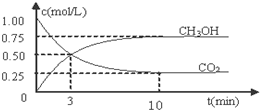
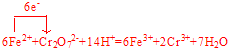 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、$NO_3^-$、Na+、$SO_3^{2-}$ | |
| B. | c(H+)=1.0×10-13mol•L-1溶液中 ${C_6}{H_5}{O^-}$、K+、$SO_4^{2-}$、Br- | |
| C. | Na2S溶液中 $SO_4^{2-}$、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 $NO_3^-$、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.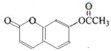 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com