
某化学兴趣小组将锌片和铜片出入番茄中制成水果电池(如图)下列说法中正确的是( )
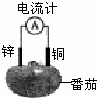
|
| A. | 一段时间后,锌片质量会变小 | B. | 铜片上发生氧化反应 |
|
| C. | 电子由铜片通过导线流向锌 | D. | 锌电极是该电池的正极 |
科目:高中化学 来源: 题型:
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液.下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②煮沸;
③加蒸馏水溶解;
④加热至不再产生气体为止;
⑤加入稍过量的Na2CO3溶液;
⑥加入稍过量的BaCl2溶液;
⑦过滤.
上述实验操作的正确顺序应是( )
|
| A. | ①②⑤⑥⑦③④ | B. | ③④⑥⑤⑦①② | C. | ④③⑥⑤⑦①② | D. | ④③⑤⑥⑦②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
据考证,商代炼铜,主要矿物原料是孔雀石,主要燃料是木炭,冶炼温度估计在1000 ℃左右,可能涉及的反应有:①Cu2(OH)2CO3 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②2CuO+C 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO Cu+CO2
Cu+CO2
④CO2+C 2CO
2CO
(1)从四种基本反应类型看,①②④分别属于________、________、________。
(2)在上述反应中,属于氧化还原反应的是__________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图照片显示:一只可爱小猫站在一块高分子合成材料上,下面烈火灼烧而小猫却若无其事.这说明此高分子材料一定具有的性质是( )

|
| A. | 良好的绝缘性 | B. | 良好的绝热性 | C. | 良好的导热性 | D. | 熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”.根据它们的主要性能,下列用途不切合实际的是( )
|
| A. | 用来做保险丝 | B. | 用于制造航天飞机 |
|
| C. | 用来制造人造骨 | D. | 用于制造船舶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
临沂市“十二五”规划指出:“加强生态文明建设,发展循环经济,推广低碳技术,推动绿色增长”。下列做法有悖于生态文明建设的是
A.加快化石燃料的开采与使用,满足经济快速发展需要
B.减少使用化学合成的农药,促进绿色食品和有机食品的生产
C.应用高效洁净的能源转换技术,提高能源的利用效率
D.在火电厂推广碳收集和储存技术
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;②用物质B表示的反应的平均速率为0.6 mol·L
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;②用物质B表示的反应的平均速率为0.6 mol·L -1·s-1;③2s时物质C的转化率为30% ;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
-1·s-1;③2s时物质C的转化率为30% ;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4 mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol/L) | 0.20 | a | 0.10 | c | d | e |
| c(NO2)/(mol/L) | 0.00 | 0.12 | b | 0.22 | 0.24 | 0.24 |
(1)表中b c(填“<”、“=”或“>”)。
(2)20s时,N2 O4的的浓度为 mol/L,0-20s内N2O4的平均反应速率为 。
O4的的浓度为 mol/L,0-20s内N2O4的平均反应速率为 。
(3)N2O4(g) 2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
(4)在其他条件相 同时,该反应的K值越大,表明建立平衡时 。
同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.N2O4的体积分数越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)该反应进行至100s以后将反应混合物的温度降低,发现气体的颜色变浅,则该反应是_______反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.食醋中含有乙酸,乙酸可由乙醇氧化得到
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D.生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com