
 2SO3
2SO3 =
= =
=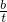 mol/(L?min)
mol/(L?min)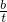 ;
;

科目:高中化学 来源: 题型:单选题
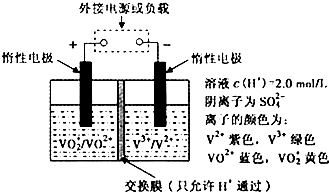
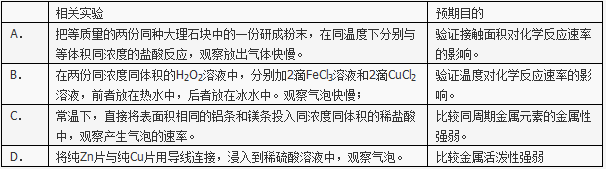
下列相关实验不能达到预期目的的是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
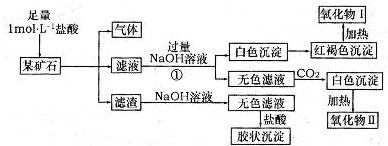
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com