
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
分析 短周期主族元素W、R、X、Y、Z的原子序数依次增大.Y原子核电荷数等于W原子核电荷数的2倍,若二者同周期,只能处于第二周期,W为Li、Y为C,则X最外层电子数为15-1-4=10,不符合题意,则W、Y同主族,可推知W为O元素、Y为S元素,X原子最外层电子数为=15-6-6=3,结合原子序数可知X为Al,Z为Cl;R原子最外层电子数与X原子最外层电子数相差1,原子序数小于Al、大于O,则R为Mg,据此解答.
解答 解:短周期主族元素W、R、X、Y、Z,原子序数依次增大.Y原子核电荷数等于W原子核电荷数的2倍,若二者同周期,只能处于第二周期,W为Li、Y为C,则X最外层电子数为15-1-4=10,不符合题意,则W、Y同主族,可推知W为O元素、Y为S元素,X原子最外层电子数为=15-6-6=3,结合原子序数可知X为Al,Z为Cl;R原子最外层电子数与X原子最外层电子数相差1,原子序数小于Al、大于O,则R为Mg.
A.R为Mg,在化合物中表现+2价,故A错误;
B.X为Al、R为Mg,金属性Mg>Al,故最高价氧化物的水化物的碱性:X<R,故B错误;
C.X为Al、R为Mg、W为O,同周期自左而右原子半径减小,电子层越多,半径越大,故原子半径:Mg>Al>Ol,故C错误;
D.R为Mg,Z为Cl,二者形成化合物为氯化镁,属于离子化合物,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:解答题
| 装置 | 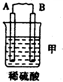 | 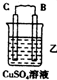 | 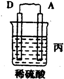 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
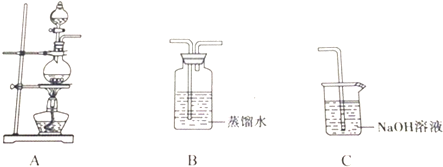
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
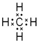
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程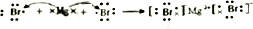 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
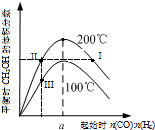 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
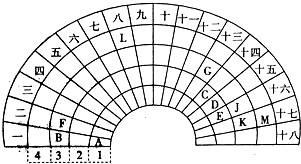
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com