


科目:高中化学 来源: 题型:
| A、工业生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 |
| B、CO会与血红蛋白结合使人中毒;可将中毒病人放入高压氧仓中解毒,其解毒原理符合平衡移动原理 |
| C、目前面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 |
| D、固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,有利于“节能减排” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应的平衡常数相等 |
| B、平衡时,两个容器中NH3的体积分数相等 |
| C、容器②中达平衡时放出的热量Q=23.15 kJ |
| D、若容器①体积为0.5 L,则平衡时放出的热大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol |
| B、0.05mol |
| C、0.2mol |
| D、0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
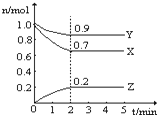 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com