
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
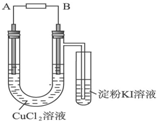 某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示.
某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示.| 64It |
| 2m×1.6×10-19 |
| 64It |
| 2m×1.6×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)A和B为两石墨电极,则B应与直流电源的______________极相连。
(2)写出B电极上电极反应式_________________________________________________,
试管中淀粉KI溶液变化的现象为_______________________________________________,
相应的离子方程式为_____________________________________________________。
(3)为精确测定电极上析出铜的质量,有下列实验步骤:①称量电解前电极质量;②刮下电解后电极上的铜并清洗;③用蒸馏水清洗电解后电极;④低温烘干电极称量;⑤低温烘干刮下的铜称量;⑥再次低温烘干后称量到恒重。实验步骤的先后顺序应是______________。
(4)通电电流为I A,通电t s后精确测得铜的质量为m g,已知电子的电量为1.6 ×10-19C,试写出阿伏加德罗常数的计算表达式:NA=___________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com