
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1 025kJmol﹣1是一个可逆反应.若反应物起始物质的量相同,则如图中关于该反应不正确的是( )
A.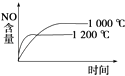
B.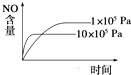
C.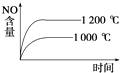
D.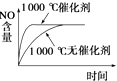
【答案】C
【解析】解:A.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故A正确;
B.正反应是气体体积增大的反应,增大压强,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故B正确;
C.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象中达到平衡的时间与实际不相符合,故C错误;
D.催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故D正确.
故选C.
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)正反应是放热反应,且正反应是气体体积增大的反应,升高温度,反应速率加快,到达平衡的时间缩短,化学平衡向逆反应方向移动,平衡时NO的含量降低;增大压强,反应速率加快,到达平衡的时间缩短,平衡向逆反应方向移动,平衡时NO的含量降低;催化剂能改变化学反应速率但不影响化学平衡.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污
B. 将三氯化铁溶于盐酸中配制三氯化铁溶液
C. 加热氯化铁溶液颜色变深
D. 硫酸氢钠溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学反应中的焓变(Δ H)与反应物和生成物的键能(E)有关。下表给出了一些化学键的键能:
化学键 | H-H | N≡N | O=O | O-H | N-H |
键能(kJ/mol) | 436 | 942 | 500 | 463 | a |
已知工业合成氨: N2(g)+3H2(g)![]() 2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
(1)表中 a = ______ kJ· mol-1
(2)1 mol N2和 3 mol H2充分反应,放出的热量______92.4 kJ(填“>”、“<”或“=”)。
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用 CO2来生产甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是_____(填“吸热”或“放热”)反应;
CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是_____(填“吸热”或“放热”)反应;

(2)下列各项中,能说明 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)已达到平衡的是____(填选项)。
CH3OH(g)+H2O(g)已达到平衡的是____(填选项)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞分子的叙述,正确的是( )
A. 携带遗传信息是核酸的唯一功能
B. 叶肉细胞中缺乏 Mg 元素,则影响叶绿素合成
C. 氨基酸的空间结构是蛋白质多样性的原因
D. 等质量脂肪氧化分解比糖释放能量多是因为脂肪分子中氧含量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中进行反应H2![]() 2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
2H,若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.036mol·L-1所需反应时间应为
A. 等于10s B. 等于12s C. 大于12s D. 小于12s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质:
A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 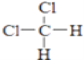 和
和 
E、CH3CH2CH2CH3和 ![]()
(1)________组两种微粒互为同位素;
(2)________组两种物质互为同素异形体;
(3)________组两种物质属于烃;
(4)________组两物质互为同分异构体;
(5)________组两物质是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是短周期中原子序数依次增大的四种元素。X可以分别与Y、Z、W 结合生成甲、乙、丙三种相同质子数的分子;相关物质之间的转化关系如图所示,已知丁是无色气体,遇空气显红棕色。下列说法正确的是
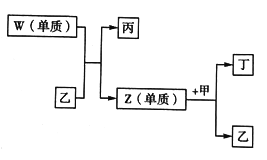
A. 原子半径的大小:W>X>Y>Z B. 单质的稳定性:X>Y>Z>W
C. 简单氢化物的沸点:Y>Z>W D. X 与Y、Z 均可形成原子个数比为2: 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
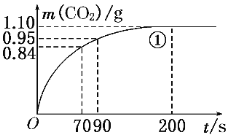
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com