
标准状况下有①6.72LCH4;②3.01×1023个HCl;③13.6gH2S;④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷(解析版) 题型:选择题
关于0.1 mol·L-1 Na2CO3溶液的叙述错误的是
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液 中含Na2CO3的质量为10.6 g
中含Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol·L-1
D .取该溶液10 mL,加水稀释至100 mL后,Na2CO 3的物质的量浓度为0.01 mol·L-1
3的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.18周考化学卷(解析版) 题型:实验题
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
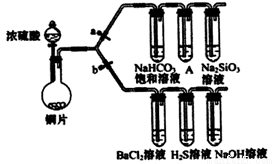
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 连接仪器、__________、加药品后,打开。关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_____________,装置A中的试剂是____________。
③ 能说明碳的非金属性比硅强的实验现象是:_________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 打开b,关闭a。能验证SO2具有氧化性的化学方程式是:______________。
② 若大量的SO2通入NaOH溶液中,其化学方程式是:_______________。
③ BaCl2溶液中无沉淀现象,将其分成两份,分滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
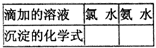
写出其中SO2显示还原性并生成沉淀的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.18周考化学卷(解析版) 题型:选择题
下列过程属于固氮的是( )
A.NH3→NO B.NO→NO2 C.N2→NO D.N2→NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期第一次月考化学试卷(解析版) 题型:推断题
现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:
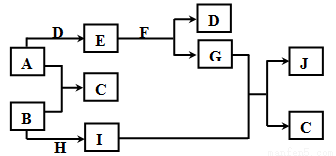
(1)写出下列物质的化学式:A ;J 。
(2)转化I+G→J+C的反应类型为 。
(3)写出下列转化的化学方程式:
①E+F→D+G: ;
②B+H→I: 。
(4)写出E物质的一种用途: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上学期第一次月考化学试卷(解析版) 题型:选择题
将30 mL 0.5mol/LNaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为
A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L
查看答案和解析>>
科目:高中化学 来源:2017届天津一中高三上第一次月考化学试卷(解析版) 题型:实验题
(一)某化学研究性学习小组讨论Fe3+和SO32﹣之间发生怎样的反应,提出了两种可能;一是发生氧化还原反应:2Fe3++SO32﹣+H2O=2Fe2++SO42﹣+2H+;二是发生双水解反应:2Fe3++3SO32﹣+6H2O=2Fe2++2Fe(OH)3(胶体)+3H2SO4,为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:N a2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是 .
a2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是 .
实验Ⅱ:取5mL FeCl3浓溶液于试管中,再滴加入 Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色,这种红褐色液体是 向红褐色液体中加入稀盐酸至过量,将所得溶液分为两等份,其中一份加入KSCN溶液变成血红色,反应的离子方程式为 .另一份加入BaCl2稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是 .
实验Ⅲ:换成两种稀溶液重复实验Ⅱ,产生现象完全相同,由上述实验得出的结论是
若在FeCl3溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无 色气体,该反应的化学方程式是 .
色气体,该反应的化学方程式是 .
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeCl3溶液反应现象差别很大,分析其可能的原因是:① ;② .
(二)镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________。
查看答案和解析>>
科目:高中化学 来源:2017届天津一中高三上第一次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示.下列说法正确的是( )

A. 原子半径:Z>Y>X
B. Z和Y形成的化合物是离子化合物
C. 气态氢化物的稳定性:Y<R
D. 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三小二调考化学试卷(解析版) 题型:选择题
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并做它与金属反应的实验。每个虚线框表示一个单元装置,其中有错误的是( )

A.只有②处 B.有①和②处 C.有②和③处 D.有②③④处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com