
【题目】含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示.下列说法正确的是
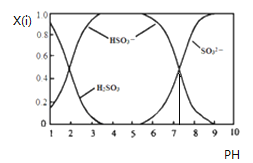
A. pH=8时,溶液中c(HSO3-)>c(SO32-)
B. pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
D. 由图中数据可估算出c(H+)×c(SO32-)/c(H2SO3)为10-7.3
【答案】C
【解析】A、当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(SO32-)>c(HSO3-),故A错误;B.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故B错误;C.根据图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;D.由图中数据,pH=2时,c(H2SO3)=c(HSO3-),H2SO3的第一级电离平衡常数Ka1=![]() =c(H+)=10-2,pH=7.3时,c(HSO3- )=c(SO32- ),H2SO3的第二级电离平衡常数Ka2=
=c(H+)=10-2,pH=7.3时,c(HSO3- )=c(SO32- ),H2SO3的第二级电离平衡常数Ka2=![]() =c(H+)=10-7.3,因此c(H+)×c(SO32-)/c(H2SO3)=
=c(H+)=10-7.3,因此c(H+)×c(SO32-)/c(H2SO3)= 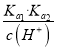 ,与溶液的pH有关,因此比值不是固定值,故D错误;故选C。
,与溶液的pH有关,因此比值不是固定值,故D错误;故选C。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】为了探索外界条件对反应:aX(g)+bY(g)![]() cZ(g)的影响,将X和Y以物质的量之比为a :b 开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示。下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a :b 开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示。下列判断正确的是

A. △H>0, a+b>c △S>0 B. △H>0, a+b<c △S<0
C. △H<0, a+b>c △S<0 D. △H<0, a+b<c △S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,还含有杂质Fe2O3 . 利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示. 
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) ![]() 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
(2)生成沉淀I的离子方程式为 , 沉淀II的化学式为 .
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 .
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: .
(5)从滤液中得到K2SO4晶体的方法是 .
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。生产合成气的反应:C(s) + H2O(g)=CO(g) + H2(g)在高温时才能自发进行。下列对该反应过程的ΔH、ΔS判断正确的是( )
A.ΔH>0,ΔS<0B.ΔH<0,ΔS<0C.ΔH>0,ΔS>0D.ΔH<0,ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
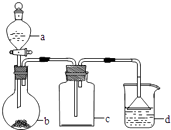
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,若缓缓加入稀硫酸直至过量,整个过程中混合溶液中的导电能力(用I表示)可近似地用下图中的曲线表示的是( ) 
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:
实验序号 | 碳酸钙状态 |
| 溶液温度/℃ | 碳酸钙消失所需时间/s | |
反应前 | 反应后 | ||||
1 | 粒状 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒状 | 0.6 | 20 | 41 | 280 |
4 | 粒状 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒状 | 1.0 | 20 | 40 | 120 |
7 | 粒状 | 1.0 | 30 | 50 | 40 |
8 | 粒状 | 1.2 | 20 | 40 | 90 |
9 | 粒状 | 1.2 | 25 | 45 | 40 |
分析并回答下列问题:
(1)本反应属于 (填“吸热”或“放热”)反应,反应的离子方程式为 。
(2)实验6和7表明, 对反应速率有影响, 反应速率越大,能表明同一规律的实验还有
(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、2与 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹硫平是一种非经典抗精神疾病的药物,对多种神经递质受体有相互作用,其结构为 ,它的合成路线如下:
,它的合成路线如下:
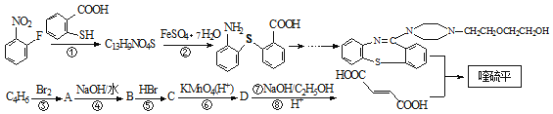
已知:(Ⅰ)反应①为取代反应;(Ⅱ)![]()
请回答下列问题:
(1)下列说法不正确的是__________
A.物质 ![]() 能发生氧化反应,不发生还原反应
能发生氧化反应,不发生还原反应
B.反应⑤的目的是保护碳碳双键,防止被氧化
C.喹硫平的分子式为C46H52S2N6O8
D.1mol物质D最多能与3molNaOH反应
(2)分子式为C13H9NO4S的物质的结构简式是___________________。
(3))物质OHCCH=CHCH=CH(CH2)4CHO的同分异构体有多种,写出符合下列条件的所有同分异构体的结构简式___________。
①与 FeCl3溶液反应显紫色;②分子中含三个甲基;③核磁共振氢谱只有四个峰.
(4)已知:-SH(巯基)的性质与-OH相似,则![]() 在一定条件下发生缩聚反应的化学方程式为________________。
在一定条件下发生缩聚反应的化学方程式为________________。
(5) 是一种重要的有机化合物。请设计合理方案,完成从
是一种重要的有机化合物。请设计合理方案,完成从![]() 到
到 的合成路线流程图(无机试剂任用)。_________________
的合成路线流程图(无机试剂任用)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.糖类、油脂和蛋白质均可发生水解反应
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com