
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:不详 题型:填空题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的Ksp的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
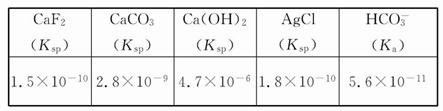
| A.由水电离出的c(H+)=10-9 mol/L的HF溶液 |
| B.pH=10的氨水 |
| C.1 mol/L的NaHCO3溶液 |
| D.10-9 mol/L的AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下在水中溶解能力AgCl>AgBr>AgI |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入NaCl固体不可能有AgCl沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl—、Br—、CrO42— | B.CrO42—、Br—、Cl— |
| C.Br—、Cl—、CrO42— | D.Br—、CrO42—、Cl— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++A2- 完成以下问题:
H++A2- 完成以下问题: CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com