2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO
2的排放问题再次成为了热点.当空气中CO
2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO
2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO
2创新利用的研究.
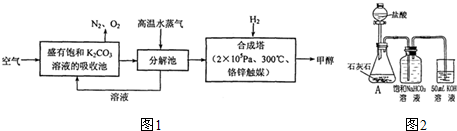
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO
2从溶液中提取出来,在一定条件下与H
2反应,使之变为可再生燃料甲醇.其流程如图1所示:

①上述流程中碳酸钾溶液所起的作用是
吸收或富集二氧化碳
吸收或富集二氧化碳
.
②在分解池中发生的反应为
(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO
2、碳酸盐、碳酸氢盐的部分性质如下:
CO
2(过量)+OH
-═HCO
3- HCO
3-+OH
-═CO
32-+H
2O
CO
32-与H
+反应生成CO
2分两步:
CO
32-+H
+═HCO
3-; HCO
3-+H
+═H
2O+CO
2↑
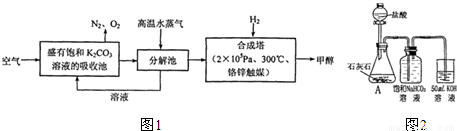
①小王同学在实验室用如图2所示的装置和药品制取K
2CO
3溶液.他所制得的溶液中可能含有的杂质是
碳酸氢钾或氢氧化钾
碳酸氢钾或氢氧化钾
.
②现有100ml氢氧化钾溶液,请你设计一方案,使其尽可能完全转化为碳酸钾溶液(只需列出实验步骤)
通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水
通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水
.
③该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如下数据:
| 实验编号 |
1 |
2 |
3 |
| 混合物的质量/g |
3.76 |
4.70 |
8.46 |
| 硫酸溶液的体积/mL |
50.00 |
50.00 |
50.00 |
| 生成二氧化碳的物质的量/mol |
0.03 |
0.0375 |
0.03 |
试计算:该混合固体中K
2CO
3与KHCO
3的物质的量之比是
2:1
2:1
;所用硫酸的物质的量浓度为
0.75
0.75
mol?L
-1.