
 计算5.6g铁粉的物质的量,铁与硫酸反应生成硫酸亚铁,Fe3O4可表示为FeO?Fe2O3,亚铁来源于硫酸亚铁,据此计算+3铁的物质的量,再根据m=nM计算FeCl3固体质量;
计算5.6g铁粉的物质的量,铁与硫酸反应生成硫酸亚铁,Fe3O4可表示为FeO?Fe2O3,亚铁来源于硫酸亚铁,据此计算+3铁的物质的量,再根据m=nM计算FeCl3固体质量; 计算9.0克MgO?2Fe2O3的物质的量,进而计算MgO、Fe2O3各自物质的量,根据工艺流程可知,MgO、Fe2O3来自氢氧化镁、氢氧化铁分解,由电荷守恒可知n(OH-)=2n(Mg2+)+3n(Fe3+),再根据V=
计算9.0克MgO?2Fe2O3的物质的量,进而计算MgO、Fe2O3各自物质的量,根据工艺流程可知,MgO、Fe2O3来自氢氧化镁、氢氧化铁分解,由电荷守恒可知n(OH-)=2n(Mg2+)+3n(Fe3+),再根据V=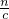 计算需要1mol/L的NaOH溶液体积;
计算需要1mol/L的NaOH溶液体积; 计算氯气的物质的量,氯气氧化Fe2+为Fe3+,根据电子转移守恒计算Fe2+的物质的量.据此确定+2价铁的物质的量.最后所得溶液为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,根据n=
计算氯气的物质的量,氯气氧化Fe2+为Fe3+,根据电子转移守恒计算Fe2+的物质的量.据此确定+2价铁的物质的量.最后所得溶液为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,根据n= 计算Fe2O3的物质的量,利用铁元素守恒计算+3价铁的物质的量,据此确定该产品化学式;
计算Fe2O3的物质的量,利用铁元素守恒计算+3价铁的物质的量,据此确定该产品化学式;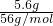 =0.1mol,铁与硫酸反应生成硫酸亚铁,Fe3O4可表示为FeO?Fe2O3,亚铁来源于硫酸亚铁,故+2价铁的物质的量为0.1mol,+3铁的物质的量为0.1mol×2=0.2mol,故需要FeCl3的物质的量为0.2mol,其质量为0.2mol×162.5g/mol=32.5g,
=0.1mol,铁与硫酸反应生成硫酸亚铁,Fe3O4可表示为FeO?Fe2O3,亚铁来源于硫酸亚铁,故+2价铁的物质的量为0.1mol,+3铁的物质的量为0.1mol×2=0.2mol,故需要FeCl3的物质的量为0.2mol,其质量为0.2mol×162.5g/mol=32.5g,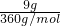 =0.025mol,故氧化物中MgO的物质的量为0.025mol、Fe2O3的物质的量为0.025mol×2=0.05mol,根据工艺流程可知,MgO、Fe2O3来自氢氧化镁、氢氧化铁分解,由电荷守恒可知n(OH-)=2n(Mg2+)+3n(Fe3+)=0.025mol×2+0.05mol×2×3=0.35mol,故需要1mol/L的NaOH溶液体积为
=0.025mol,故氧化物中MgO的物质的量为0.025mol、Fe2O3的物质的量为0.025mol×2=0.05mol,根据工艺流程可知,MgO、Fe2O3来自氢氧化镁、氢氧化铁分解,由电荷守恒可知n(OH-)=2n(Mg2+)+3n(Fe3+)=0.025mol×2+0.05mol×2×3=0.35mol,故需要1mol/L的NaOH溶液体积为 =0.35L=350mL;
=0.35L=350mL;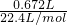 =0.03mol,才能把溶液中的Fe2+全部氧化为Fe3+,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,计算得到亚铁离子物质的量为0.06mol,亚铁离子的浓度=
=0.03mol,才能把溶液中的Fe2+全部氧化为Fe3+,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,计算得到亚铁离子物质的量为0.06mol,亚铁离子的浓度=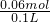 =0.6mol/L;
=0.6mol/L;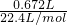 =0.03mol,氯气氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为
=0.03mol,氯气氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为 =0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为
=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为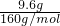 =0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,故FeO与Fe2O3的物质的量之比为0.06mol:
=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,故FeO与Fe2O3的物质的量之比为0.06mol: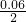 =2:1,该产品化学式为2FeO?Fe2O3,
=2:1,该产品化学式为2FeO?Fe2O3,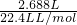 =0.12mol;即为溶液中氮元素的量,也即1.92-0.12=1.8mol,是溶液中硝酸根离子的物质的量,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol,一个铬铁氧体分子中分子中只有一个铬原子,二者是一比一关系,那么消耗铬铁氧体的量就是0.2mol;
=0.12mol;即为溶液中氮元素的量,也即1.92-0.12=1.8mol,是溶液中硝酸根离子的物质的量,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol,一个铬铁氧体分子中分子中只有一个铬原子,二者是一比一关系,那么消耗铬铁氧体的量就是0.2mol;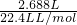 ,然后根据反应式的对应关系,根据二价铁(等于消耗铬铁氧体的量)的含量为3x+y=0.2,联立方程解出得x=0.04 y=0.08,则x:y=1:2
,然后根据反应式的对应关系,根据二价铁(等于消耗铬铁氧体的量)的含量为3x+y=0.2,联立方程解出得x=0.04 y=0.08,则x:y=1:2

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届山西省太原五中高三10月月考理科化学试卷(带解析) 题型:填空题
(8分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 ;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:计算题
(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市普陀区高三第一学期期末考试化学试卷(解析版) 题型:选择题
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:计算题
(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:

根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com