
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。
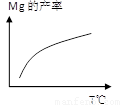
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
(1)20℅(2分)
(2)①1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,故能发生(2分);
② 吸热(2分);不变(∵K= [Mg]2,∴温度不变,K值不变);(2分)
④0.025 mol/(L·h) [或25 mol/(m3·h),2分,单位不写扣1分]
【解析】
试题分析:(1)已知Q2=4Q1,容器甲乙中发生的反应是等效的,故Q2+Q1=Q,即5Q1=Q,因此甲容器中H2的转化率为w = Q1/Q=20℅;
(2)①1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,故能发生;②随着温度的升高,产率逐渐增大,故反应正向为吸热;K= [Mg]2,温度不变,K值不变,故达到新平衡时Mg(g)的浓度不变;
④2(CaO·MgO)(s) + Si(s)  Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
192 48
9.6t×50% m
m = 1.2t,n = (1.2×106g)/ 24g/mol = 50000mol
这段时间Mg的生成速率v = 50000mol÷(400×103)L ÷ 5h =" 0.025" mol/(L·h)
考点:可逆反应的等效平衡,反应影响因素,反应速率的计算
点评:本题综合考查学生对可逆反应的化学平衡的掌握,涉及化学方程式的计算,计算较为简单,总体难度不大。


科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省六校(省一级重点校)高三3月联考化学试卷(解析版) 题型:选择题
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:

下列有关该钒电池的说法不正确的是:
A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高
B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色
C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应
D.充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)增加了0.5mol
1023个,左槽溶液中n(H+)增加了0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com