
 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.分析 (1)①4Na(g)+3CO2(g)═2Na2CO3(l)+C(s,金刚石)△H=a kJ•mol-1
②CO2(g)+4Na(g)═2Na2O(s)+C(s,金刚石)△H=b kJ•mol-1
由盖斯定律可知,①-②×3得到反应6Na2O(s)+2C(s,金刚石)═8Na(g)+2Na2CO3(l);
(2)①若降低温度,K值减小,可知降低温度,平衡逆向移动;
②A.增加Na2SO4(s)的量,速率无影响;
B.当混合气体的质量为变量,则密度为变量;
C.保持温度不变,向平衡体系中再通入一定量的H2,反应物浓度增大,△H与浓度无关;
D.其他条件不变,升高温度,则v(正)、v(逆)均增大;
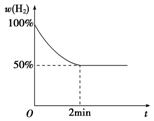
③若2min内反应达到平衡,此时气体质量增加了8g,则
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)△m
4 64
x 8
则x=$\frac{4×8}{64}$=0.5mol,
结合v=$\frac{△c}{△t}$计算速率;
由图可知,氢气的转化率为50%,则转化的氢气为0.5mol,平衡时氢气为0.5mol、水蒸气为0.5mol,以此计算K;
④若反应达平衡后,加入一定量的H2,体积温度不变,压强增大,但该反应为气体体积不变的反应.
解答 解:(1)①4Na(g)+3CO2(g)═2Na2CO3(l)+C(s,金刚石)△H=a kJ•mol-1
②CO2(g)+4Na(g)═2Na2O(s)+C(s,金刚石)△H=b kJ•mol-1
由盖斯定律可知,①-②×3得到反应6Na2O(s)+2C(s,金刚石)═8Na(g)+2Na2CO3(l),则△H=(a-3b)kJ/mol,
故答案为:(a-3b);
(2)①若降低温度,K值减小,可知降低温度,平衡逆向移动,则正反应为吸热反应,反应的△H>0,故答案为:>;
②A.增加Na2SO4(s)的量,速率无影响,反应速率不变,故A错误;
B.当混合气体的质量为变量,则密度为变量,则混合气体的密度一定时,该反应达到平衡状态,故B正确;
C.保持温度不变,向平衡体系中再通入一定量的H2,反应物浓度增大,△H与浓度无关,则△H不变,故C正确;
D.该反应为吸热反应,其他条件不变,升高温度,则v(正)、v(逆)均增大,且平衡向右移动,故D错误;
故答案为:AD;
③若2min内反应达到平衡,此时气体质量增加了8g,则
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)△m
4 64
x 8
则x=$\frac{4×8}{64}$=0.5mol,
用H2表示的反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{0.5mol}{2L}}{2min}$=0.125 mol•L-1•min-1;
由图可知,氢气的转化率为50%,则转化的氢气为0.5mol,平衡时氢气为0.5mol、水蒸气为0.5mol,则K=$\frac{(\frac{0.5mol}{2L})^{4}}{(\frac{0.5mol}{2L})^{4}}$=1,
故答案为:0.125 mol•L-1•min-1;1;
④若反应达平衡后,加入一定量的H2,体积温度不变,压强增大,但该反应为气体体积不变的反应,平衡不移动,则再次平衡后H2O的体积分数不变,
故答案为:不变.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、速率及K的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意结合盖斯定律计算反应热,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com