
| A. | C | B. | N | C. | Si | D. | P |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | MnO4-… | Cl2、Mn2+… |
| ③ | Cl2、FeBr2 | FeCl3、FeBr3 |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第②组反应中生成lmol Cl2,转移电子5mol | |
| C. | 第③组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
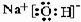 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的浓度不随时间而发生变化 | B. | 反应体系的总压强恒定 | ||
| C. | c(X):c(Y)=1:3 | D. | 每生成3mol的Y同时生成lmol的X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 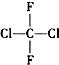 和 和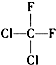 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
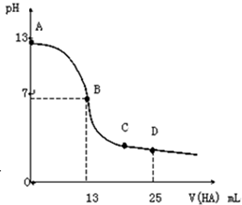 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com