
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
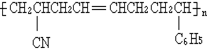 工程塑料ABS树脂(结构简式如图,式中-C6H5是苯基),合成它的单体有( )
工程塑料ABS树脂(结构简式如图,式中-C6H5是苯基),合成它的单体有( )| A、①③⑥ | B、②③⑤ |
| C、②④⑤ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①②④ |
| C、①③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BAEDC |
| B、CDBAE |
| C、ABCDE |
| D、ECDBA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石硬度大于硅,其熔点也高于硅 |
| B、HF、HCl、HBr、HI热稳定性依次减弱 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol/LNa2SO4溶液含有的Na+和SO42-的总物质的量为0.9mol |
| B、1 L 水吸收22.4L 氨气所得氨水的浓度为1mol/L |
| C、在NaC1和K2SO4的混合溶液中,如果Na+和SO42-的物质的量相等,则K+和C1-的物质的量浓度相等 |
| D、10℃时100 mL0.35 mol?L-1的KC1饱和溶液蒸发掉5克水冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液中滴加足量硫酸溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、氢氧化钡溶液中滴加少量硫酸溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钡溶液中滴加足量NaHSO4溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、氢氧化钡溶液中滴加少量NaHSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com