


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
 某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、K与M、N均断开时,该装置中无反应发生 |
| B、K与M、N均断开时,Zn表面有Cu析出 |
| C、K与M相连时,电流由铜片流向锌片 |
| D、K与N相连时,铜片溶解,锌片质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CHOH) |
| n(CO) |
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1molCH3OH | 2molCH3OH |
| CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
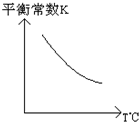 工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上利用反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=Q kJ?mol-1,制备H2.已知该反应的平衡常数K与温度的关系如图所示.若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
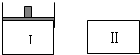 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)?3Z(g).此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B、若X、Y不均为气态,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y的体积分数变大 |
| C、若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ |
| D、若X、Y不均为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2是还原产物 |
| B、NaOH是氧化产物 |
| C、Na2O2是氧化剂,水是还原剂 |
| D、Na2O2中,-1价的氧既得电子,又失电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com