
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 100gKHCO3晶体中含有的离子数为3NA
B. 一定条件下,将71gCl2和足量的PCl3混合充分反应,可得到NA个PCl5分子
C. 3molFe在纯氧中完全燃烧转移的电子数为8NA
D. 标准状况下,22.4L正戊烷中含有共价键的数目为16NA
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
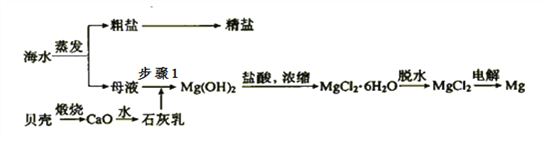
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有以下物质:①盐酸;②NH3;③氯气;④BaSO4;⑤硫酸;⑥金刚石;⑦石灰水;⑧乙醇。以上物质中属于混合物的是_________(填序号,下同),属于电解质的是_____。
(2)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:装置图中仪器A的名称_______,仪器B的名称________,冷却水从______口进,从______口出(填上或下)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程没有起到氮的固定作用的是( )
A.N2与O2反应生成NO
B.N2与H2在一定条件下合成氨
C.NH3经催化氧化生成NO
D.豆科植物的根瘤菌将空气中的氮气转化为含氮化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列说法正确的是( )

A. a、d两点的溶液中Ba2+均恰好沉淀完全
B. b点的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. d点溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
D. 溶液中由水电离的c(OH-)大小关系:a=d>c>b滴入溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以化工厂铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下:

已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)根据下图信息,操作B的最佳方法是_______________________。

(2)“母液”中主要含有的离子为_________________。
(3)酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为______________。
(4)酸化、还原操作时,酸C和Na2SO3溶液是____________(填“先后加入”或“混合后加入”),理由是___________________________。
(5)若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为____________。
(6)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。
Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业采用高温分解H2S制取氢气,2H2S(g) ![]() 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g) ![]() 2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________。


(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________。
③通入H2S 时发生如下反应,补全离子方程式:_________________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com