
| A、碘的非金属性较弱 |
| B、碘分子(I2)中I---I键不稳定 |
| C、碘晶体属于分子晶体 |
| D、碘的氧化性较弱 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3的热稳定性大于Na2CO3 |
| B、SiO2与酸、碱均不反应 |
| C、常温下,NO易与空气中氧气发生化合反应 |
| D、氯化氢与氨气相遇,有大量的白雾生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ(NH3)=0.0100mol?L-1?s-1 |
| B、υ(O2)=0.0010mol?L-1?S-1 |
| C、υ(NO)=0.0010mol?L-1?s-1 |
| D、υ(H2O)=0.045mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、对于有气体参加的反应,增大压强,反应速度一定加快 |
| D、催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
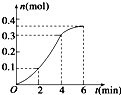
| A、反应在第2min到第4 min内生成CO2的平均反应速率为前2min的2倍 |
| B、反应开始4min内温度对反应速率的影响比浓度大 |
| C、反应速率先增大后减小 |
| D、反应开始2min内平均反应速率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com