
【题目】能正确表示下列反应的离子方程式的是( )
A.用惰性电极电解MgCl2溶液:2Cl﹣+2H2O ![]() ?Cl2↑+H2↑+2OH﹣
?Cl2↑+H2↑+2OH﹣
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O
C.过氧化钠与水反应:2O22﹣+2H2O=4OH﹣+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH﹣+Al3++2SO42﹣=2BaSO4↓+AlO2﹣+2H2O
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,  的名称为2﹣甲基﹣3,5﹣二乙基己烷
的名称为2﹣甲基﹣3,5﹣二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯和硝基苯四种物质
C.等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加
D.葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+ , 现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( ) 
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I﹣═2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.共有1molFeSO4被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
A.CH4?14H2O
B.CH4?8H2O
C.CH4? ![]() H2O
H2O
D.CH4?6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 , 微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 . 
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为 gcm﹣3(列出计算式即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中不能按如图所示的关系一步转化的是( ) 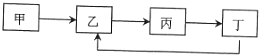
选项 | 甲 | 乙 | 丙 | 丁 |
A | S | SO2 | SO3 | H2SO4 |
B | Al | Al2O3 | AlCI3 | Al(OH)3 |
C | Na | Na2O2 | Na2CO3 | NaOH |
D | Si | SiO2 | Na2SO3 | H2SiO3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的五元环代表A,B,C,D,E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ![]() ,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
(1)B为二元弱酸,其水溶液显弱酸性,则B在水溶液的第一步电离方程式可表示为 .
(2)D的化学式是 , E电子式为 .
(3)液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式 .
(4)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.E与NH3分子类似,也可与HCl发生反应,试写出E与足量盐酸发生反应的化学方程式 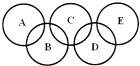
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( ) 
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com