
 Fe(s)+ CO2(g) ��H>0
Fe(s)+ CO2(g) ��H>0  2SO3��10min��Ӧ��ƽ��ʱ��3molSO3���ɡ��Լ��㣺
2SO3��10min��Ӧ��ƽ��ʱ��3molSO3���ɡ��Լ��㣺 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ƽ�ⳣ�����¶ȵĸı���ı� |
B�������ܱ������з�Ӧ2SO2+O2 2SO3��2���SO2������O2��Ӧ��������2���SO3 2SO3��2���SO2������O2��Ӧ��������2���SO3 |
| C���ϳɰ���Ӧ��ʹ�ô����������˷�Ӧ����Ҫ�Ļ�ܡ� |
D����ӦH2(g)��I2(g)  2HI(g) ��450��ʱ����ƽ�ⳣ��Ϊ49����Ӧ 2HI(g) ��450��ʱ����ƽ�ⳣ��Ϊ49����Ӧ |
 1 �M 2 H2(g) ��1 �M 2 I2(g) ��450��ʱ��ƽ�ⳣ��Ϊ1 �M 7
1 �M 2 H2(g) ��1 �M 2 I2(g) ��450��ʱ��ƽ�ⳣ��Ϊ1 �M 7�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2B(g)+E(g)(����ӦΪ���ȷ�Ӧ)�ﵽƽ��ʱ��Ҫʹ����Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ��
2B(g)+E(g)(����ӦΪ���ȷ�Ӧ)�ﵽƽ��ʱ��Ҫʹ����Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ��| A������ | B����ѹ | C������E��Ũ�� | D����ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
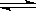 eC(g )+dD (g) ��H<0������֤���÷�Ӧһ���ﵽƽ��״̬����
eC(g )+dD (g) ��H<0������֤���÷�Ӧһ���ﵽƽ��״̬�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
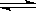 R(g) + S(g)������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ�����
R(g) + S(g)������˵���п��Գ��˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ�����| A��P��Q��R��S��Ũ����� |
| B��P��Q��R��S���ܱ��������� |
| C��P��Q��R��S��Ũ�Ȳ��ٱ仯 |
| D����P����ʾ�ķ�Ӧ��������Q��ʾ�ķ�Ӧ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g��
CH3OH��g��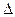 H1
H1 CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��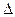 H2
H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
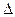 H1 ��(�>����=����<��)��
H1 ��(�>����=����<��)�� ��ijʱ�̲�ø���ֵ�Ũ�����£�
��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g) + H2(g)����H=" -Q" kJ��mol-1��Q>0������֪�ﵽƽ��ʱ��COΪ0.12mol���Իش�
CO(g) + H2(g)����H=" -Q" kJ��mol-1��Q>0������֪�ﵽƽ��ʱ��COΪ0.12mol���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 SiF4(g)+ 2H2O(g) ��H =��148.9 kJ��mo1��1
SiF4(g)+ 2H2O(g) ��H =��148.9 kJ��mo1��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
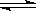 4NH3(g)+3O2(g) ��H =" a" kJ��mol-1
4NH3(g)+3O2(g) ��H =" a" kJ��mol-1| �¶�T/K | 303 | 313 | 323 |
| NH3������/(10��6mol) | 4.8 | 5.9 | 6.0 |
 g)
g) 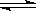 3NH3(g) ��H =" ��92.4" kJ��mol-1
3NH3(g) ��H =" ��92.4" kJ��mol-1 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l) 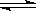 4NH3(g) + 3O2��g����H = _________����3�֣�
4NH3(g) + 3O2��g����H = _________����3�֣��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com