
【题目】能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
A.乙烯B.苯C.乙烷D.乙酸
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+===Fe2+ + 2Fe3+ + 4H2O
B. Na2O2 加入H218O 中:2Na2O2 + 2H2l8O ===4Na+ + 4OH-+ 18O2↑
C. 水玻璃中通入过量二氧化碳:Na2SiO3 +CO2 + H2O===2Na+ +CO32- + H2SiO3↓
D. 成分为盐酸的洁厕灵与“84”消毒液混合使用易中毒:C1—+ C1O—+ 2H+=== Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月的eLife上发表了我国医学工作者的一篇论文。论文指出小苏打在治疗癌症的方法中功不可没。在实验室中制取NaHCO3的方法有多种。
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl固体粉末,有NH4Cl晶体析出。
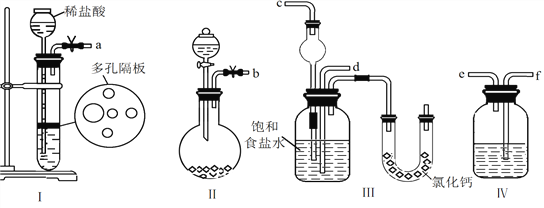 (1)图中所示装置的连接顺序是:a接f;e接________;b接________(填接口编号)。
(1)图中所示装置的连接顺序是:a接f;e接________;b接________(填接口编号)。
(2)Ⅰ中盛放稀盐酸的仪器名称是__________,Ⅱ中圆底烧瓶盛放试剂名称是__________,Ⅳ中应选用的液体为__________,实验室检验Ⅱ中生成气体的方法________________________。
(3)第二步中让__________(填序号)装置先发生反应。
(4)第四步中所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________________________。
方法二:把CO2通入饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):
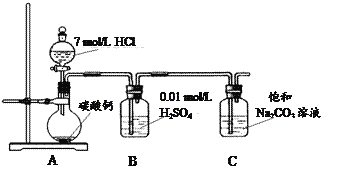
(5)装置B的作用之一是吸收挥发出来的HCl气体,另一作用可能为___________________(请结合化学平衡移动原理解释)
(6)NaHCO3溶液中含碳粒子浓度由大到小排序__________________________________
方法三:电解Na2CO3溶液也可生成NaHCO3,装置如图所示。
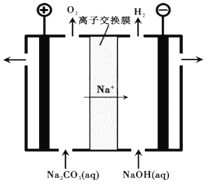
(7)①简述阳极液NaHCO3生成的原理:___________________________。
②产品NaHCO3中常混有Na2CO3,测试NaHCO3含量的方法是:准确称取样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的标准盐酸溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用盐酸溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用盐酸溶液滴定至溶液由黄变橙,所用盐酸溶液体积为V2mL。写出产品中NaHCO3质量分数的计算式:______________用c、V1、V2、W表示);若配制标准液盐酸定容时俯视刻度线,则测得NaHCO3质量分数___________(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:
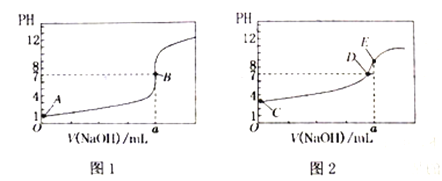
(1)由A、C点判断,滴定HCl溶液的曲线是__(填“图1”或“图2”)。
(2)a=___mL。
(3)c(Na+)=c(CH3COO-)的点是_______。
(4)E点对应离子浓度由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述不正确的是
A. 新制氯水中只含Cl2和H2O两种分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡产生,该气体是O2
D. 氯水长时间放置后酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 标准状况下,22.4LCCl4中所含C—C1键的数目为4NA
B. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C. 向密闭容器中充入1molN2O4,加热使之充分分解,生成NO2的分子数为2NA
D. 7.8gNa2O2中阴离子所含的电子数为1.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:

(1)水从冷凝管的______(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | ﹣ |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于__________反应(填字母)。
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是______(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):___________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)欲分离出乙酸乙酯,应使用的分离方法是__________(填操作方法名称,下同),所用到的仪器为______ , 进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法。
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是_______。
(6)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。
(1)过氧化钙制备方法很多。
①制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为:____________________________________________________________。
②制备方法二:利用反应CaC2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4Cl,在碱性环境中制取CaO2。NH3·H2O在Ca2+和H2O2的反应中所起的作用是_____________________________________________;该反应需要在冰水浴条件下完成,原因_____________________________________________。
③制备方法三:利用反应Ca(s)+O2 ![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下
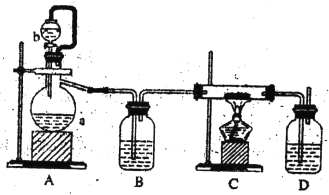
请回答下列问题
装置A中反应的化学方程式为______________________________;
仪器a的名称为_______________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是______________________________。
(2)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+40Hˉ=2MnO(OH)2↓;
酸性条件下,MnO(OH)2将Iˉ氧化为I2:MnO(OH)2+2Iˉ+4H+=Mn2++I2+3H2O;
用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O32-+2Iˉ
取加过一定量量:CaQ2·8H2O的池塘水样100.0mL,按上述方法测定水中溶氧量,消耗0.020mol·L-1Na2S2O3标准溶液6.75mL。滴定过程中使用的指示剂是_______________;该水样中的溶解氧量(DO)为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L(标准状况下)某气态烃,完全燃烧生成的CO2和水蒸气在273 ℃、1.01×105 Pa下体积为y L,当冷却至标准状况时体积为x L。下列用x、y表示该烃的化学式正确的是
A. CxHy-2x B. CxHy-x C. CxH2y-2x D. CxHy
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com