
 ̽����������������������ǿ��������ͭ��Ӧ�Ļ�ԭ��������ʣ�
̽����������������������ǿ��������ͭ��Ӧ�Ļ�ԭ��������ʣ����� ��1������Ũ���ᡢϡ���ᡢŨ���ᡢϡ������ͭ��Ӧ�������������
��2�����ݷ����ķ�Ӧ��֪XΪ��������YΪ������������������Һ�������������
��3�����ݣ�2���е�����Ӧ�����жϣ�
��� �⣺��1��Ũ���᳣���¾�����Cu��Ӧ��������ͭ������������ˮ��ϡ���������Ա�Ũ����������������Cu��Ӧ����NO������ͭ��ˮ����Ӧ�ϻ�����Ũ���᳣����Cu����Ӧ�����������·�Ӧ��������ͭ�����������ˮ��ϡ������Cu����Ҳ����Ӧ���ʴ�Ϊ���ۡ��ܡ��١��ڣ�
��2��ͭ��Ũ���ᷴӦ����������XΪ������������������ˮ�������������Ȼ�������Ӧ�����Կ�ʼ������ͭ��Ũ���ᷴӦ�����Ĵ�������YΪ����������������������ˮ�������ᣬ�����ܰ�����������Ϊ���ᣬ�������Ȼ����������ᱵ��ɫ�������ʴ�Ϊ��BC��
��3��������������ˮ�������������Ȼ�������Ӧ��������������Ա�H2SO3ǿ����BaSO3��������������ܰ�����������Ϊ���ᣬ��������ᱵ��������˵��BaSO4������ˮҲ������HNO3��Һ���ʴ�Ϊ��BCDE��
���� ���⿼����Ũ���ᡢϡ���ᡢŨ���ᡢϡ����ֱ���ͭ��Ӧ��ʵ�飬����ʵ��̽������Ŀ���Ѷ��еȣ�ע��Ũ�����ϡ������ͭ��Ӧ����IJ��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ����Ҷ�����Ϊͬϵ�� | |
| B�� | �������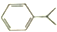 ��������̼ԭ�ӿ��ܶ�����ͬһƽ�� ��������̼ԭ�ӿ��ܶ�����ͬһƽ�� | |
| C�� | ��ϵͳ�������������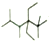 ����������2��3��5��5һ�ļ�һ4��4һ���һ����� ����������2��3��5��5һ�ļ�һ4��4һ���һ����� | |
| D�� | 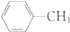 ��һ������ ��һ������ 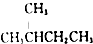 ��һ����ﶼ��4�֣������������칹�� ��һ����ﶼ��4�֣������������칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100 mL 1 mol/L�������к�HCl������Ϊ0.1NA | |
| B�� | 7.8 g Na2O2��Na2S�Ļ��������������ĿΪ0.2NA | |
| C�� | ��״���£�2.24 L SO3�к�����ԭ����ĿΪ0.3NA | |
| D�� | 2 g D216O�к����ӡ����ӡ�������Ŀ��ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��¯ˮ����Na2CO3��Һ����һ��ʱ����������ܽ� | |
| B�� | ��Mg��OH��2����Һ�еμ�FeCl3��Һ��������ɫ���� | |
| C�� | NaH2PO4��Һ�����ԣ�Na2HPO4��Һ�Լ��ԣ�������Һ�ж��е���ƽ���ˮ��ƽ�� | |
| D�� | �����ʵ���Ũ�ȵģ�NH4��2CO3����NH4��2SO4����NH4��2Fe��SO4��2������Һ��NH${\;}_{4}^{+}$Ũ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgCl����ת��ΪAgI | |
| B�� | 25��ʱ��0.1mol/L HF��ҺpH=l | |
| C�� | ��1L0.1 mol/LHF��Һ�м���1L 0.1 mol/LCaCl2��Һ��û�г������� | |
| D�� | 25��ʱ��ʹAgClת��ΪAgI�������KI��Һ��Ũ�Ȳ�����5��10-12 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ͭ��һ�ֺ�ɫ��ĩ�����������ʹ�����ɫ�����������������л��ϳɵĴ�����Ϊ��ô���������ͭ��̽�������ʣ�ij��ѧ��ȤС�����÷Ͼ�ӡˢ��·��������ͭ��ʵ����Դ��������������Ⱦ��
����ͭ��һ�ֺ�ɫ��ĩ�����������ʹ�����ɫ�����������������л��ϳɵĴ�����Ϊ��ô���������ͭ��̽�������ʣ�ij��ѧ��ȤС�����÷Ͼ�ӡˢ��·��������ͭ��ʵ����Դ��������������Ⱦ��| ʵ����� | �� | �� | �� |
| KClO3���� | 1.2g | 1.2g | 1.2g |
| ������������ | ���������� | CuO 0.5g | MnO2 0.5g |
| �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ��ʾ��ͼ���ң���ȼ�ϵ�ع���ʱ�����·�е��ӵ����������Ǵӵ缫1���缫2����ص��ܷ�ӦΪ4NH3+3O2=2N2+6H2O��
���ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ��ʾ��ͼ���ң���ȼ�ϵ�ع���ʱ�����·�е��ӵ����������Ǵӵ缫1���缫2����ص��ܷ�ӦΪ4NH3+3O2=2N2+6H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʵ�������ˮ�ĵ���̶ȵı仯�������ȼ�С������ | |
| B�� | ���μ���������ҺpH��7ʱ����ʱ��Һ������һ����HCl��NH4Cl | |
| C�� | ���μ���������ҺpH=7ʱ����ʱ��Һ�У�c��NH4+����c��Cl-�� | |
| D�� | ���μ�������ǡ����ȫ�к�ʱ��c��Cl-����c��NH4+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com