
2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:下列说法正确的是( )

A.①、②反应依次为还原反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
两种气态烃以一定比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L,下列混合烃中不符合此条件的是( )
A.CH4、C2H4 B.CH4、C3H6 C.C2H4、C3H4 D.C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:填空题
I、某有机物的结构简式如下图所示
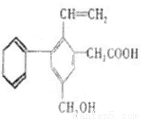
试回答:
(1)该有机物的分子式 ,苯环上一氯代物有 种。
(2)含有官能团的名称
(3)1mol该有机物分别与足量的H2、溴水反应需消耗H2 mol,Br2 mol
(4)该有机物与金属钠反应的化学方程式为
(5)该有机物在Cu催化下发生氧化反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列各组有机化合物中,肯定属于同系物的一组是( )
A.C3H6与C5H10 B.C3H8与C5H12 C.C2H6O与C5H8O D.C7H8与C6H6
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
亚硝酸钠可大量用于染料和有机合成工业。请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。写出反应的离子方程式 。
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:
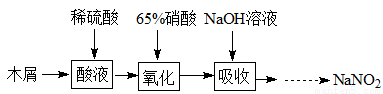
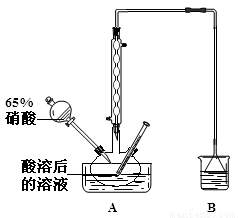
已知:(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是 。
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH?外还有两种阴离子,其中一种是NO2?,NO2?与另一种阴离子的物质的量之比为 。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100 mL溶液;
II.从步骤I配制的溶液中移取20.00 mL加入锥形瓶中;
III.用c mol·L?1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体 积为V mL。
积为V mL。
①锥形瓶中发生反应的离子方程式为 。
②滴定至终点的现象为 。
③ 产品中NaNO2的纯度为 (写出计算表达式)。
产品中NaNO2的纯度为 (写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:实验题
[化学――选修2:化学与技术]草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含两个结晶水)的工艺流程如下:
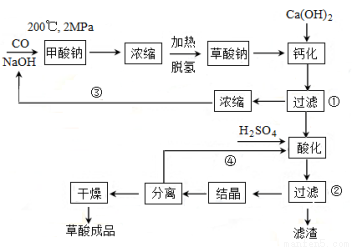
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 、 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 _____;过滤操作②的滤液是 __和 ,滤渣是________ 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,W的最内层电子数是最外层的1/3,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述不正确的是
A.原子半径: rY < rW < rZ
B.Y形成的离子与W形成的离子的电子数可能相同
C.化合物ZY、WY3中化学键的类型相同
D.由X、Y、Z、W组成的化合物的水溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C第一电离能由大到小的顺序为: (用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是: (填化学式);该分子中心原子的杂化类型为: 。
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是 ;(填化学式,下同)酸根呈平面三角形的酸是 。
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为 ;F的配位数为 。
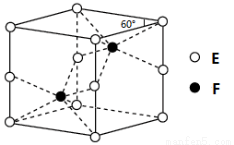
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的
最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某
配合物,向该配合物的溶液中滴加AgNO3溶液产生
淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为: ;n值为 ;Dn+的基态电子排布式为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com