
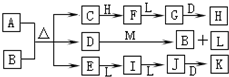
 如图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A.
如图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A.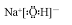 ,
,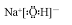 ;
;| 7.8g |
| 78g/mol |
| 0.8mol |
| 2 |
| 0.8mol |
| 0.2mol |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2015届海南省高一上学期期末考试化学试卷(解析版) 题型:推断题
(16分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
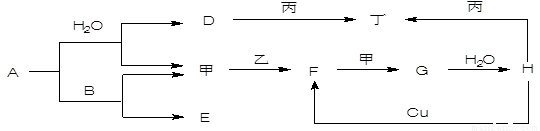
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________
(2)写出下列反应的化学方程式:
A与B _________________________________________________________;
(3)写出丙与D溶液反应的离子方程式 ______________________________;
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期一调考试化学试卷(解析版) 题型:推断题
(共5分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
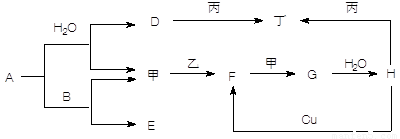
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_________ ____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com