
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,对应反应:2A(g)+B(g)=3C(g)+4D(g),
A、$\frac{vA}{2}$=0.45 mol/(L•s);
B、0.5 mol/(L•s)
C、$\frac{1.4}{3}$mol/(L•s)≈0.47mol/(L•s);
D、$\frac{1.8}{4}$mol/(L•s)=0.45mol/(L•s);故B表示的反应速率最快,
故选B.
点评 本题考查了化学反应速率快慢的比较,难度不大,注意要把不同物质的反应速率换算成同一物质的反应速率进行比较,还要注意单位是否相同.


科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
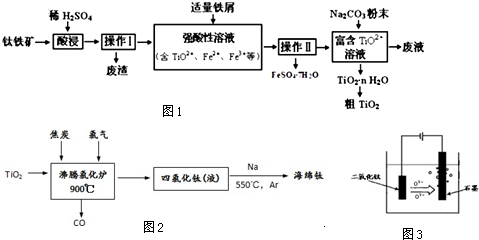
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
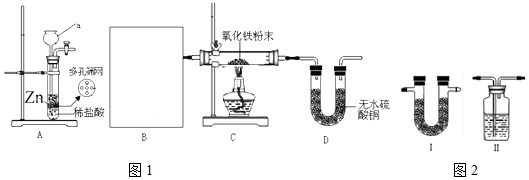
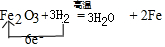 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com