
【题目】铝是一种重要金属,从铝土矿(主要成分为Al2O3 , Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
(1)溶液A中含的阳离子主要有 .
(2)写出步骤II生成溶液C 的离子方程式 , 步骤I、II、III都要用到的分离方法是 .
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有(填化学式).
(4)生产中曾用铝与氧化铁的混合物形成铝热剂发生铝热反应焊接钢轨(提示:反应中能生成铁单质),则铝与氧化铁在高温下发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数)(用含a、b的最简式表示).
【答案】
(1)Al3+、Fe3+、H+
(2)Al3++4OH﹣=AlO ![]() +2H2O;过滤
+2H2O;过滤
(3)CO2、NaOH
(4)2Al+Fe2O3 ![]() Al2O3 +2Fe
Al2O3 +2Fe
(5)![]() ×100%
×100%
【解析】解:由工艺流程可知,铝土矿(主要成分为Al2O3 , Fe2O3、SiO2等),铝土矿与过量的盐酸反应得沉淀B和溶液A,则固体B为SiO2 , 过滤得滤液A含有氯化铝、氯化铁、盐酸等,滤液中加入过量的NaOH,可推知沉淀D为氢氧化铁,过滤得滤液C含有偏铝酸钠、氯化钠,所以向滤液C中通入二氧化碳,生成氢氧化铝沉淀与溶液E为碳酸氢钠或碳酸钠溶液,过滤后向E溶液中加入氧化钙得沉淀G为碳酸钙,同时得到氢氧化钠溶液,氢氧化钠溶液可以循环利用,碳酸钙煅烧分解得氧化钙和二氧化碳都可以循环利用,Al(OH)3灼烧得氧化铝,电解熔融的氧化铝可得铝,(1)由上述分析可知溶液A中含的阳离子主要有 Al3+、Fe3+、H+ , 所以答案是:Al3+、Fe3+、H+;(2)步骤II过量的氢氧化钠与氯化铝反应生成偏铝酸钠,反应的离子方程式为Al3++4OH﹣=AlO2﹣+2H2O,根据上面的分析可知,步骤I、Ⅱ、Ⅲ都要用到的分离方法是 过滤,所以答案是:Al3++4OH﹣=AlO2﹣+2H2O;过滤;(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有CO2、NaOH,所以答案是:CO2、NaOH;(4)铝与氧化铁发生反应的化学方程式为2Al+Fe2O3 ![]() Al2O3 +2Fe,所以答案是:2Al+Fe2O3
Al2O3 +2Fe,所以答案是:2Al+Fe2O3 ![]() Al2O3 +2Fe;(5)a吨铝土矿可以冶炼出b吨的铝,则由铝元素守恒可知,需要纯氧化铝的质量为
Al2O3 +2Fe;(5)a吨铝土矿可以冶炼出b吨的铝,则由铝元素守恒可知,需要纯氧化铝的质量为 ![]() b吨,所以原铝土矿中Al2O3的纯度为
b吨,所以原铝土矿中Al2O3的纯度为 ![]() ×100%=
×100%= ![]() ×100%,所以答案是:
×100%,所以答案是: ![]() ×100%.
×100%.


科目:高中化学 来源: 题型:
【题目】某同学想通过比较最高价氧化物对应水化物酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置.请回答:
(1)仪器a的名称是 , 应盛放下列试剂中的 . A.稀硫酸B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是 , 应盛放下列试剂中的 . A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是 , 如果看到的现象是 , 证明b中反应产生了 , 即可说明比酸性强,比非金属性强,b中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Kw=1.0×10﹣14 , Al(OH)3AlO2﹣+H++H2O K=2.0×10﹣13 . 则Al(OH)3溶于NaOH溶液反应的平衡常数数值为( )
A.10
B.15
C.20
D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.建筑钢筋属于金属材料
B.制玻璃和水泥都要用到石灰石
C.天然气、水煤气、液化石油气均是化合物
D.聚乙烯、纤维素都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Kw=1.0×10﹣14 , Al(OH)3AlO2﹣+H++H2O K=2.0×10﹣13 . 则Al(OH)3溶于NaOH溶液反应的平衡常数数值为( )
A.10
B.15
C.20
D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写方程式:
(1)H2CO3的电离方程式______________________________________________________;
(2)AgCl的沉淀溶解平衡方程式_______________________________________________;
(3)NaHCO3 溶液与 AlCl3溶液混合的离子方程式_______________________________;
(4)向CaSO4悬浊液中加入固体Na2CO3 ,写出对应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中c(NO3﹣)为6.0molL﹣1 , 用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为4mol/L
B.原溶液中c(Cu2+)为1mol/L
C.电解后溶液中c(H+)为8mol/L
D.电解后加入1molCu(OH)2可使溶液复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性. 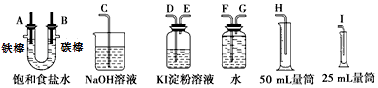
(1)A极发生的电极反应式是 , B极发生的电极反应式是 .
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接、接;B接、接 .
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8mL(标准状况).此时溶液pH约为 . (lg2=0.3,lg3=0.5,lg5=0.7)
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验.若甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(已知NA=6.02×1023mol﹣1 , 电子电荷为1.60×10﹣19C,列式表示即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com