
某化肥厂用氨气制备![]() ,已知由
,已知由![]() 制NO的产率是96%,NO制
制NO的产率是96%,NO制![]() 的产率是非曲直92%,
的产率是非曲直92%,![]() 跟
跟![]() 反应生成
反应生成![]() ,则制
,则制![]() 所用去的
所用去的![]() 点总耗
点总耗![]() 量的百分之几(不考虑生产上的其它损耗)?
量的百分之几(不考虑生产上的其它损耗)?
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:简答题
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
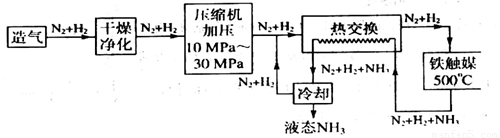
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com