
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
分析 A.NaOH是强电解质,在水溶液中完全电离,NH3.H2O是弱电解质,在水溶液中部分电离;
B.pH=13的两种溶液,氨水浓度大于NaOH,加水稀释促进NH3.H2O,导致稀释后c(OH-)NaOH小于氨水;
C.消耗酸的物质的量与碱的物质的量和元数有关;
D.硫酸钠是强酸强碱盐,不影响NaOH的电离;硫酸铵电离出铵根离子而抑制NH3.H2O电离.
解答 解:A.NaOH是强电解质,在水溶液中完全电离,NH3.H2O是弱电解质,在水溶液中部分电离,所以等物质的量的两种溶液中c(OH-)NaOH大于氨水,故A错误;
B.pH=13的两种溶液,氨水浓度大于NaOH,加水稀释促进NH3.H2O,导致稀释后c(OH-)NaOH小于氨水,所以氨水的pH大于11,故B错误;
C.两种物质都是一元碱,等物质的量的氨水和NaOH完全被HCl中和时,消耗盐酸的物质的量相等,故C正确;
D.硫酸钠是强酸强碱盐,不影响NaOH的电离;硫酸铵电离出铵根离子而抑制NH3.H2O电离,所以c(OH-)前者不变、后者变小,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点、弱电解质电离影响因素是解本题关键,侧重考查学生分析能力及知识运用能力,易错选项是C,注意该选项中消耗酸的物质的量与碱的强弱无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
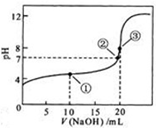 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
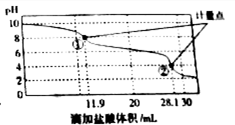 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
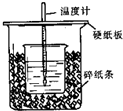 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
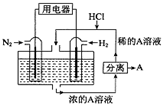 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com