
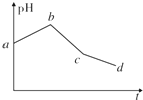
 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
分析 用惰性电极电解相等体积的KCl和CuSO4混合溶液,阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:
第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;
第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑(或2H2O-4e-═4H++O2↑),阴极反应先发生Cu2++2e-═Cu,反应中生成硫酸,溶液pH降低;
第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低.
解答 解:用惰性电极电解等体积的KCl和CuSO4混合溶液,阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:
第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;
第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑(或2H2O-4e-═4H++O2↑),阴极反应先发生Cu2++2e-═Cu,反应中生成硫酸,溶液pH降低;
第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低.
A.ab段由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,氢离子为被还原,故A错误;
B.由上述分析可知,电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑,故B正确;
C.电解至c点时,溶液中溶质为硫酸、硫酸钾,往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,故C错误;
D.图象中具体数量关系未知,不能原混合溶液中KCl和CuSO4的浓度之比,故D错误,
故选:B.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,根据电解过程中溶液中氢离子浓度变化判断发生的反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 150 mL 3 mol•L-1氯酸钾溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | [A-]=[K+] | B. | [H+]=[OH-]<[K+]<[A-] | C. | V总≥30mL | D. | V总≤30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将容器容积压缩一半,平衡向右移动,达到新平衡时c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移动,达到新平衡时N2的体积分数小于20% | |
| C. | 若达到新平衡时c(H2)=2.5mol•L-1,则改变的条件可能是降温或加压 | |
| D. | 若改变条件后,H2的百分含量增大,则平衡一定向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | Mg原子结构示意图: | |
| D. | 硫酸铁的电离方程式 Fe2(SO4)3=2Fe3++3SO42ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )| A. | 若将CH3COOH改为HCl,P点温度高于28℃ | |
| B. | 从M到N过程中c(H+)逐渐减小 | |
| C. | 混合溶液的导电能力:N>M | |
| D. | 实验的环境温度等于22℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com