
��830 Kʱ�����з�Ӧ��ƽ����ϵ����ijЩ�����ԣ�
CO(g)��H2O(g)![]() CO2(g)��H2(g)
CO2(g)��H2(g)
������ʼŨ�ȷֱ�Ϊc(CO)��3 mol��L��1��c(H2O)��0.75 mol��L��1���ﵽƽ���CO��ת����Ϊ20��
������ʼŨ�ȷֱ�Ϊc(CO)��3 mol��L��1��c(H2O)��4.5 mol��L��1���ﵽƽ���CO��ת����Ϊ60��
��830 Kʱ������ʼŨ�ȷֱ���c(CO)��3a mol��L��1��c(H2O)��b mol��L��1Ͷ�ϣ��������Ϸ�Ӧ�����ƽ���c(H2)��c mol��L��1��
��ע���������ݣ��ܽ�����й��ɣ���д���¿հף�
(1)ѡ����գ��ڶ�������У�������b�������Сa����ﵽƽ��ʱCO��ת����________ˮ������ת����________��
A������B����С����C�����䡡��D����ȷ��
(2)��a��4��c��1.5ʱ��b��_____________��
(3)��a��2bʱ��a��c��_________________��
(4)a��b��c�ڸ�ƽ���еĹ�ϵʽ��________��
 �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��д���¿հף�
��830 Kʱ����ʼŨ��c(CO)=a mol��L-1��c(H2O)=b mol��L-1��
��Ӧ�ﵽƽ��ʱc(H2)Ϊc mol��L-1��
��1����b���䡢a��С�����´ﵽƽ��ʱ��CO��ת����________��H2O��ת����________������ߡ������͡������䡱����
��2����a=4��c=1.5ʱ��b=________;
(3)��a=bʱ��![]() =________;
=________;
(4)���Ա�ʾa��b��c֮���ϵ�Ĵ���ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
������ʼŨ�ȷֱ�Ϊc(CO)=3 mol��L-1,c(H2O)=0.75 mol��L-1ʱ���ﵽƽ���CO��ת����Ϊ20%��
������ʼŨ�ȷֱ�Ϊc(CO)=3 mol��L-1,c(H2O)=4.5 mol��L-1ʱ���ﵽ��ƽ���CO��ת����Ϊ60%��
��ͨ�������ͼ�������������⣺
��830 Kʱ��������ʼŨ�ȷֱ�Ϊc(CO)=a mol��L-1,c(H2O)=b mol��L-1Ͷ�ϣ��������Ϸ�Ӧ�����ƽ���c(H2)=c mol��L-1��
��1��ѡ��ش��ڶ��ʵ���У�������b�������Сa����ﵽƽ���CO��ת����____________��H2O��ת����_______________��
A.���� B.��С C.���� D.��ȷ��
��2����a=4,c=1.5ʱ��b=__________________��
��3����a=2bʱ��a��c=___________________��
��4��a��b��c�ڸ�ƽ����ϵ�еĹ�ϵʽΪ________________________��
����ʾ���ȷֱ�������������ˮ��ת���ʣ��ҳ�CO��H2Oת����֮���������ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��6�֣����¶�Ϊ830��Kʱ�����п��淴Ӧ����ijЩ�������ʣ�CO+H2O![]() H2+CO2����ʼŨ��[CO]Ϊ2mol/L��[H2O]= 3mol/L����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ60%�������H2O����ʼŨ�ȼӴ�6mol/L����CO��ת����Ϊ75%����ע�������й����ݣ����ܽ�����ɣ�����������⣺
H2+CO2����ʼŨ��[CO]Ϊ2mol/L��[H2O]= 3mol/L����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ60%�������H2O����ʼŨ�ȼӴ�6mol/L����CO��ת����Ϊ75%����ע�������й����ݣ����ܽ�����ɣ�����������⣺
��830��Kʱ����ʼŨ��c(CO)Ϊamol/L��c(H2O)Ϊbmol/L����Ӧ�ﵽƽ��ʱc(H2)Ϊcmol/L��
��1����b����ʱ��a���٣����´ﵽƽ��ʱ��CO��ת���� ��H2O��ת���� ��������������½������䡱��
��2����a=5��c=![]() ʱ��b=
ʱ��b=
��3����a=bʱ��![]() =
=
��4�����Ա�ʾa��b��c֮���ϵ�Ĵ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��6�֣����¶�Ϊ830��Kʱ�����п��淴Ӧ����ijЩ�������ʣ�CO+H2O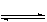 H2+CO2����ʼŨ��[CO]Ϊ2mol/L��[H2O]= 3mol/L����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ60%�������H2O����ʼŨ�ȼӴ�6mol/L����CO��ת����Ϊ75%����ע�������й����ݣ����ܽ�����ɣ�����������⣺
H2+CO2����ʼŨ��[CO]Ϊ2mol/L��[H2O]= 3mol/L����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ60%�������H2O����ʼŨ�ȼӴ�6mol/L����CO��ת����Ϊ75%����ע�������й����ݣ����ܽ�����ɣ�����������⣺
��830��Kʱ����ʼŨ��c(CO)Ϊamol/L��c(H2O)Ϊbmol/L����Ӧ�ﵽƽ��ʱc(H2)Ϊcmol/L��
��1����b����ʱ��a���٣����´ﵽƽ��ʱ��CO��ת���� ��H2O��ת���� ��������������½������䡱��
��2����a=5��c=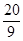 ʱ��b=
ʱ��b=
��3����a=bʱ��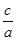 =
=
��4�����Ա�ʾa��b��c֮���ϵ�Ĵ���ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com