
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.某溶液加稀硫酸生成白色沉淀,说明原溶液中有Ba2+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的数值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.2.4g Mg变为Mg2+时失去的电子数目为0.2NA
C.1 L 1molL﹣1 CH3COONa溶液中存在NA个CH3COO﹣
D.1 mol Cn H2n+2含有(3n+2)NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2
CH2===CH2
CH2===CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
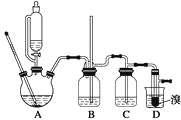
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十二届全国人民代表大会政府工作报告中强调“加强雾霾治理,淘汰黄标车和老旧车”,下列物质不属于空气污染物的是
A.CO2 B.SO2 C.NO2 D.PM2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别下列各组物质,只能采用焰色反应的是( )
A.K2CO3 和NaCl
B.KCl和NaNO3
C.NaCl 和MgCl2
D.NaCl 和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
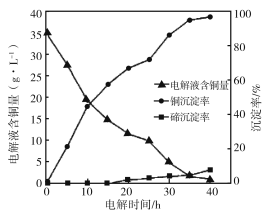
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com