
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
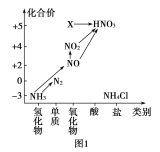
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O A 4NH3+5O2
CaCl2+2NH3↑+2H2O A 4NH3+5O2![]() 4NO+6H2O 无色气体变红棕色 1:2 H2O2 AD
4NO+6H2O 无色气体变红棕色 1:2 H2O2 AD
【解析】
(1)NH4Cl与Ca(OH)2混合加热反应产生CaCl2、NH3、H2O;
(2)氨气是一种碱性气体,会与酸发生反应;
(3)在工业上氨气被催化氧化产生NO,NO与氧气反应产生NO2,NO2被水吸收得到HNO3。根据电子守恒、一种守恒配平方程式,判断氧化剂、还原剂的物质的量的比,根据物质的颜色判断反应现象;
(4)只用一种物质将NO直接转化为硝酸且绿色环保,还原产物无污染;
(5)若要将NH3→N2,N元素的化合价由-3价变为0价,氨气被氧化,加入的物质应该有强的氧化性。
(1)NH4Cl与Ca(OH)2混合加热,发生复分解反应,反应产生CaCl2、NH3、H2O,反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气是一种碱性气体,能与酸发生反应,而不能与碱反应,因此不能使用浓硫酸干燥,可以使用碱石灰、NaOH固体干燥,故合理选项是A;
(3)①NH3与O2在催化剂存在条件下加热,发生氧化反应产生NO和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②NO在室温下很容易与O2反应产生NO2,NO是无色气体,NO2是红棕色气体,所以反应的实验现象是看到气体由无色变为红棕色;
③NO2被水吸收得到HNO3,反应方程式为:3NO2+H2O=2HNO3+NO,在该反应中,NO2既作氧化剂,又作还原剂,氧化剂与还原剂物质的量之比为1:2。
(4)图中实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为H2O2;
(5)若要将NH3→N2,由于N元素的化合价由-3价变为0价,氨气被氧化,则加入的物质应该有强的氧化性。
A.O2可以将NH3氧化为N2,A符合题意;
B.金属Na具有强的还原性,不能氧化NH3,B不符合题意;
C.NH4Cl中N元素化合价也是-3价,不能与氨气反应产生氮气,C不符合题意;
D.NO2中N元素化合价也是+4价,能与氨气反应产生氮气,D符合题意;
故合理选项是AD。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
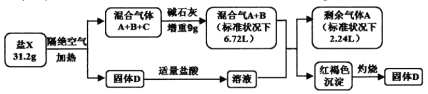
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中短周期主族元素W、X、Y、Z,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z元素原子在同周期中原子半径最小。下列说法错误的是( )
A.Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂
B.X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为:![]()
C.Y与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生
D.W与X形成的含有极性共价键的化合物不只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水与1mol水中,中子数比为2:1
D.1mol乙烷与1mol乙烯中,共价键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷的某些物理数据如下表:

在实验室里可用如图装置制备一氯甲烷:
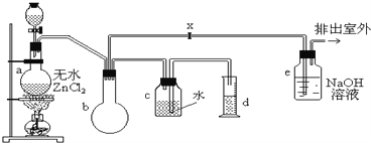
制备装置的分液漏斗中盛有甲醇,烧瓶中盛有浓盐酸。
请填写下列空白:
(1)制备一氯甲烷的化学方程式是__________;该反应属于反应__________;
(2)装置e中可能发生反应的化学方程式是__________________;
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃的燃烧现象有明显区别,且生成物中有HCl),CH3Cl燃烧的化学方程式是____________;
(4)装置b的作用是________,某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的量比理论计算的量多(装置的气密性没有问题),其原因是________,实验结束后,d中收集到的液体中含有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2.2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是( )
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 若它变成1 mol C5H12至少需要2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气与氢气在催化剂表面发生合成氨反应的微粒变化历程如图所示。
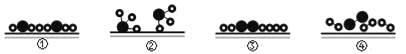
下列关于反应历程的先后顺序排列正确的是( )
A.④③①②B.③④①②C.③④②①D.④③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com