
| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |
分析 HC≡C-CH2CH3和CH2═CH-CH═CH2都含有不饱和键,可发生加成、加聚和氧化反应,其中HC≡C-CH2CH3具有乙炔和烷烃的结构特点,CH2═CH-CH═CH2具有烯烃的结构特点,以此解答该题.
解答 解:A.HC≡C-CH2CH3含有饱和烃基,具有甲烷的结构特点,所有原子不可能在同一平面上,故A错误;
B.两种有机物含碳量较大,则都能在空气中燃烧,且燃烧时均伴有黑烟,故B正确;
C.都含有不饱和键,可被KMnO4酸性溶液氧化,故C正确;
D.与足量溴水反应分别生成HCB2rCBr2-CH2CH3和CH2BrCHBrCHBrCH2Br,产物不同,故D错误.
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答的关键,侧重炔烃、烯烃的性质及官能团判断的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Si用于制造光导纤维 | |
| B. | 过氧化钠可用作潜艇供氧剂 | |
| C. | 水玻璃浸泡过的木材既能防腐又能耐火 | |
| D. | 常温下,铁槽、铝槽可存放冷的浓硝酸、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8n | B. | 18n | C. | 13n | D. | 44n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2SO3制备少量SO2:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O | |
| B. | Na2SO3溶液使酚酞试剂变红:SO${\;}_{3}^{2-}$+H2O═OH-+HSO${\;}_{3}^{-}$ | |
| C. | 用Ba(NO3)2溶液检验HSO${\;}_{3}^{-}$:HSO${\;}_{3}^{-}$+Ba2+═BaSO3↓+H+ | |
| D. | 用NaHSO3溶液检验H2S气体:2H2S+H++HSO${\;}_{3}^{-}$═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
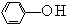 )中羟基被硫羟基取代生成苯硫酚(
)中羟基被硫羟基取代生成苯硫酚(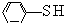 ),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
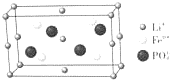 锂的某些化合物是性能优异的材料.请回答:
锂的某些化合物是性能优异的材料.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com