
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附。取一块制作炭雕的下脚料,进行下面的实验。下列有关叙述不正确的是( )

A.将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体
B.将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色
C.将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体
D.将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )

A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B.2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )

A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.离子半径:Cl->S2->F-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示。其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是 ( )
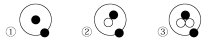
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
A.a、f B.b、c C.d、e D.e、f
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
我国成功地发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月球表层5 cm厚的沙土中就含铁单质上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(MgFe)2SiO6]等,下列说法或分析不正确的是( )
A.辉石、斜长石及橄榄石均属于硅酸盐
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:______________________________________ (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______________________,该电池总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:选择题
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- K+ AlO2- OH-
D.NO3- Ca2+ K+ Cl-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:填空题
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
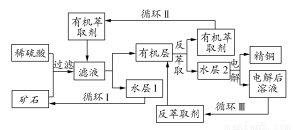
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为 。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环Ⅲ”中反萃取剂的主要成分是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com