
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量NaNO3溶液;③将稀硫酸换为98%的硫酸;④加入少量水;⑤加热;其中可提高H2的生成速率的措施有( )
A. ①③B. ①⑤C. ②⑤D. ②④
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)见图。下列说法正确的是( )

A. FeSO4·7H2O晶体中有4种不同结合力的水分子
B. 在100 ℃时,M的化学式为FeSO4·6H2O
C. 在200 ℃时,N的化学式为FeSO4·3H2O
D. 380 ℃的P加热至650 ℃的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中能分别代替KClO3和镁带引发铝热反应的是( )
A.直接用酒精喷灯加热
B.KMnO4、铝条
C.火柴头、浓盐酸
D.KMnO4、鞭炮引线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe2+、Ba2+、H+、SO42-、CO32-。为了进一步确认,对该溶液进行实验检测:

步骤一:仔细观察,该溶液呈无色、透明、均一状态。
步骤二:加入足量BaCl2溶液,生成23.3g 白色沉淀,再加稀硝酸,沉淀不消失。
(1)原溶液中除上图中的离子以外,肯定还含有的离子是________,肯定不含有的离子是________。
(2)实验操作的步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、______________、检验沉淀已洗干净的方法是____________。
(3)原溶液中H+物质的量浓度为_________mol/L。
(4)向原溶液中加入NaHCO3溶液,反应的离子方程式为_____________。
(5)若向100 mL原溶液中加入1mo/L 的Ba(OH)2溶液,当生成的沉淀质量刚好最大时,则加入的Ba(OH)2溶液体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种香料,可从柑橘类物质中提取,它的一种合成路线如下 
已知:
①D能与碳酸氢钠溶液反应
②G核磁共振氢谱显示其分子中含有2种不同化学环境的氢原子;
③CH3CHO+CH3CHO ![]()
![]()
回答下列问题:
(1)A→B的反应类型为
(2)E的名称为F的结构简式为
(3)反应①的化学方程式为
(4)反应⑤的化学方程式为
(5)D有多种同分异构体,写出符合下列条件的D的所有同分异构体的结构简式:(不考虑立体异构) I.笨坏上含有三个取代基
Ⅱ.不能与NaHCO3溶液反应
Ⅲ.能发生银镜反应和水解反应
IV.核磁共振氢谱有4组峰
(6)参照上述合成路线,设计一条以A为原料制备  的合成路线.
的合成路线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
(1)有关热化学方程式如下: 水煤气法:CH4(g)+ ![]() O2(g)═CO(g)+2H2O(g)△H1=﹣35.4KJmol﹣1
O2(g)═CO(g)+2H2O(g)△H1=﹣35.4KJmol﹣1
CO(g)+2H2(g)CH3OH(g)△H2=﹣90.1KJmol﹣1
直接氧化法:
2CH4(g)+O2(g)2CH3OH(g)△H3=KJmol﹣1 .
(2)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2 , 在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示. ①二氧化碳合成甲醇正反应的△H(填“>”“<”或“=”,下同)0.
②M、N两点时化学反应速率:v(M)v(N).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是 .
④图中M点时,容器体积为10L,则N点对应的平衡常数K=(填数值,保留2位小数).
(3)一定条件下,向容积不变的某密闭容器中加入amolCO2和bmolH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在没有通风装置时制取并且收集氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。

(1)烧杯中盛放的液体是_____,水槽中盛放的液体是______。
(2)写出制取氯气的化学方程式:____________________。
(3)将8.7gMnO2与含HCl的质量为14.6g的浓盐酸共热制Cl2,甲同学认为可制得Cl27.1g,乙同学认为制得Cl2的质量小于7.1g,你认为________(填“甲”或“乙”)同学正确,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有种,这些电子的电子云形状有种;氟原子的外围电子排布式为 .
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有;与HF2﹣互为等电子体的分子有(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为 , 画出N2F2可能的结构式 .
(4)三氟化硼乙醚(如图1)的熔点为﹣58℃,沸点为126~129℃,它属于晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555pm. ①Ca2+、F﹣的配位数分别为和 .
②列式表示氟化钙晶体的密度:gcm﹣3(不必计算出结果).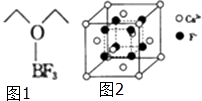
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com