
科目:高中化学 来源: 题型:
| A、其它条件不变,增大压强,平衡不发生移动 | ||||
| B、其它条件不变,增大压强,混合气体的总质量不变 | ||||
C、反应可以从正反应开始,也可以从逆反应开始,但必须满足下列条件:其中x、y、z分别表示第一次达到平衡时,A、B、D的物质的量(mol),(其中M表示物质的摩尔质量,下同)
| ||||
D、反应只能从正反应开始,且原混合气中A与B的物质的量之比为2:1,并有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
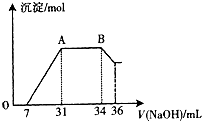 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
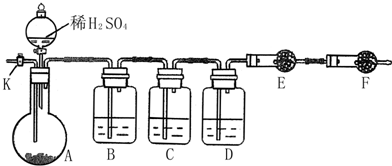 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
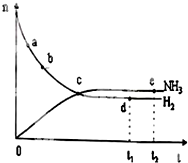 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的逆反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
| D、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com