
 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.


科目:高中化学 来源: 题型:阅读理解
高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极的电极反应式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是_______。研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,原因可能是__ ____。
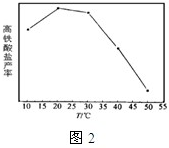
(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )

A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6 h后电流效率几乎为0
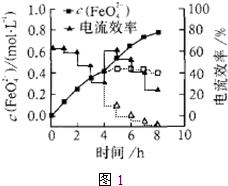
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2)。随温度升高,高铁酸盐产率先增大后减小的原因是 。

(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
A.将1 mol Fe3O4氧化成高铁酸盐需10/3 mol电子,可提高电流效率
B.以低价态铁的氧化物为电极,可以实现变废(铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现“钝化”现象
查看答案和解析>>
科目:高中化学 来源:2010年江苏省南京市高三上学期期中考试化学试题 题型:实验题
(18分)高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于饮用水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极产生高铁酸钠的电极反应方程式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会产生氧气使阳极表面生成Fe2O3膜而“钝化”。写出产生O2的电极反应方程式: 。
(3)FeO42—易与水4h生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图中4h后)过滤掉氢氧化铁,反应过程中FeO42—浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是 (填编号)

①过滤:掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
②过滤掉氢氧化铁对电流效率影响不大
③实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)在相同的pH条件下,经过相同的反应时间,高铁酸盐的产率与温度关系如图2。

随温度升高,高铁酸盐产率先增大后减小的原因是 。
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值有 (至少答一点)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009年广东省潮州市湘桥区金山中学高考化学三模试卷(解析版) 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com